文献解读 | 关爱婴幼儿健康,Biacore在肠道病毒致病机理研究与药物开发中的应用
肠道病毒受体分为介导病毒粘附和脱衣壳两类。2019 年,中科院微生物所高福团队在 Cell 期刊上发表文章,揭示了 B 族肠道病毒通过双受体系统入侵宿主细胞(见扩展阅读)。2020 年,该团队再接再厉,在 PNAS 期刊发表文章,鉴定了含有 Kringle 结构域的跨膜蛋白 1(KRM1)为 A 族肠道病毒入侵细胞的重要受体,并系统地研究了其作用机制以及病毒入侵的过程。
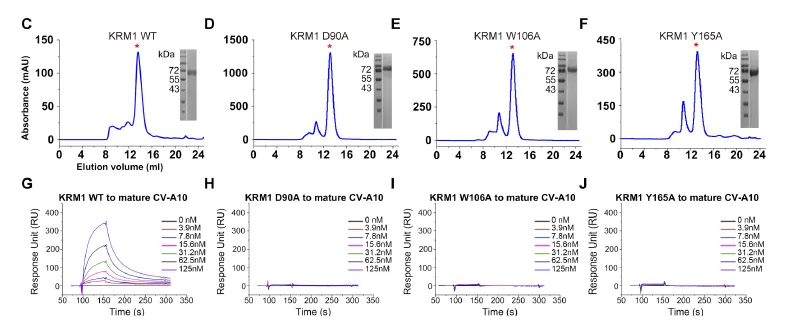
在这篇文章中,研究人员就大量使用 Biacore 检测病毒粒子与相关受体的结合情况。首先,研究人员利用 Biacore 研究了 CV-A10 的成熟病毒粒子与 KRM1 受体在中性(生理条件)及酸性(内吞体条件)环境下的相互作用。CV-A10 成熟病毒粒子通过生物素化修饰,固定在 SA 芯片上,固定量约 6000RU。KRM1 的可溶胞外结构域及其 D90A,W106A,Y165A 突变体使用 PBST 缓冲液进行梯度稀释后,依次进样 1 min,解离 2 min,通过参比通道及 0 浓度进行双扣减保证数据质量。在每次进样后,使用 3M MgCl2 进行芯片表面再生。
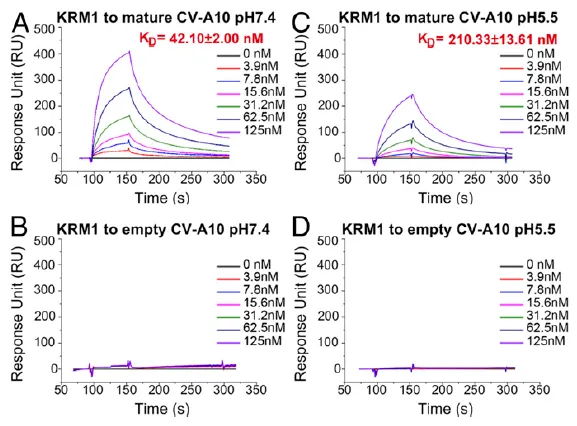
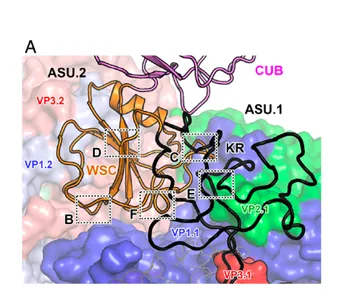
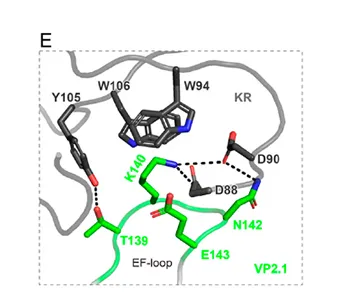
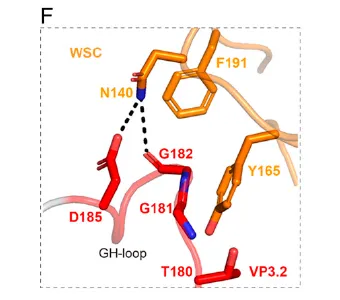
随后,研究人员利用冷冻电镜技术,解析了 CV-A10 病毒与 CV-A10/KRM1 复合物在中性和酸性 pH 条件下高分辨电镜结构,揭示了 KRM1 与 CV-A10 病毒结合的分子模式。KRM1 通过其 KR 结构域(黑)与 WSC 结构域(橙)同时与病毒表面 VP1(蓝)、VP2(绿)、VP3(红)发生相互作用,横跨由 VP1 蛋白形成的「峡谷」样结构部位(图 2A),并显示出 KRM1 上 3 个重要的氨基酸位点 D90,W106(图 2E),Y165(图 2F)。
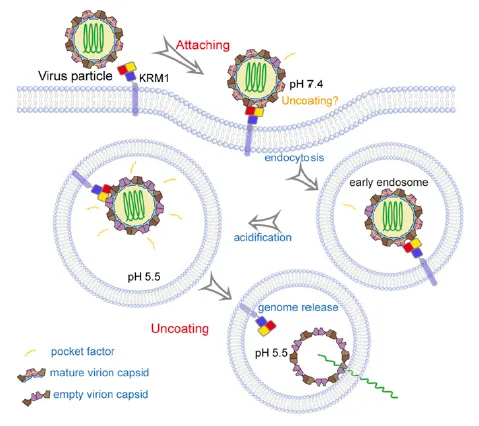
KRM1 在 CV-A10 入侵过程中发挥了「一石二鸟」(two in one)的功能,同时介导病毒粘附及脱衣壳两个过程(图 4)。
小 结
厦门大学国家传染病诊断试剂与疫苗工程技术研究中心的夏宁邵教授团队在肠道病毒研究领域有多年经验,先后在 Nature Communications 2017(见扩展阅读),Science Advances 2018,Nature Microbiology 2019,Cell Host & Microbe 2020 上发表多篇肠道病毒重要病原体 CVA6、CVA10、EVD68 和 CVA16 的研究论文。今年 2 月,他们又在 Cell Host & Microbe 发表文章,阐明了柯萨奇 B 组病毒(CVB)与其脱衣壳受体(柯萨奇病毒-腺病毒受体,CAR)相互作用及变构过程的精细特征,从分子水平上揭示了 CAR 介导 CVB 病毒高效脱衣壳的作用机制与关键位点,并在此基础上发现了可模拟受体作用特征,诱导 CVB 成熟病毒颗粒失稳及崩解的高效治疗性抗体。
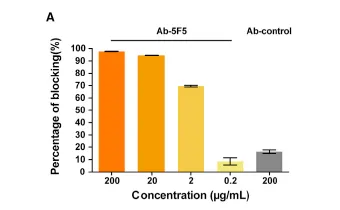
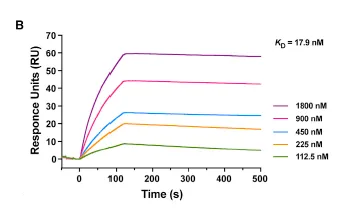
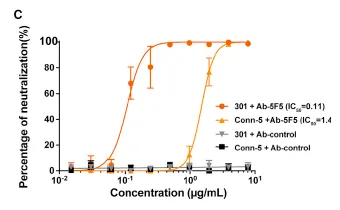
在这篇文章中研究人员使用 CVB1 成熟病毒粒子皮下免疫小鼠,筛选以 CAR 结合位点为目标的单克隆抗体。竞争 ELISA 实验表明,单克隆抗体 5F5 以浓度依赖的方式,有效抑制 CAR 与 CVB1 成熟病毒粒子的结合(图 5A),表明 5F5 的结合位点也许重合或接近 CAR 结合区域。然后,研究人员使用 Biacore 8K 研究了抗体 5F5 与 CVB1 成熟病毒粒子的相互作用。他们使用 ProteinA 芯片捕获抗体,将成熟病毒粒子进行两倍梯度稀释后进样,最后使用 10 mM Glycine pH1.5 进行再生。Biacore 检测结果显示 5F5 以高亲和力(17.9 nM)结合成熟病毒粒子(图 5B)。随后,基于细胞的中和实验进一步证实了 5F5 的高中和活性,对 CVB1 301 毒株 IC50 0.11 μg/mL,对 Conn-5 毒株 IC50 1.49 μg/mL(图 5C)。
选择 Biacore,选择高效,选择可靠!
中科院微生物所,Molecular basis of Coxsackievirus A10 entry using the two-in-one attachment and uncoating receptor KRM1,Proc Natl Acad Sci U S A. 2020 Aug 4; 117(31): 18711–18718.
厦门大学,Cryo-EM structures reveal the molecular basis of receptor-initiated coxsackievirus uncoating,Cell Host Microbe. 2021 Feb 3;S1931-3128(21)00001-9.
扩展阅读:
南开大学,Serotype specific epitopes identified by neutralizing antibodies underpin immunogenic differences in Enterovirus B,Nat Commun. 2020; 11: 4419.
中科院微生物所,Human Neonatal Fc Receptor Is the Cellular Uncoating Receptor for Enterovirus B,Cell. 2019 May 30; 177(6): 1553–1565.e16.
厦门大学,Atomic structures of Coxsackievirus A6 and its complex with a neutralizing antibody,Nat Commun. 2017 Sep 11;8(1):505.

 收藏
收藏 询价
询价