8个案例分享阿尔茨海默症疾病机理和药物研发
争议如此之大原因有二,一是不同人从不同角度对aducanumab的临床数据评价不同;二是Alzheimer疾病作为世界性重大疾病,无论是对于病人自身健康还是整个社会负担都造成全球范围内的重大影响,而人类对Alzheimer疾病的认知仍然十分匮乏,研究进展异常缓慢。基于以上两点,任何在Alzheimer疾病领域的进展,都会引起全球范围内的关注。

01
Alzheimer疾病研究机理
新基因功能的发现,揭示新的功能复合物及潜在药物靶点
在《Activity of the poly(A) binding protein MSUT2 determines susceptibility to pathological tau in the mammalian brain》研究中,一个新基因功能的发现,揭示新的信号通路及药物靶点。
2型Tau 蛋白病哺乳动物抑制因子 (MSUT2)是秀丽隐杆线虫 SUT-2 基因在哺乳动物中的同源基因,研究人员通过对于具有正常MSUT2的死亡AD病人脑组织的检测发现:tau 病理相关的神经炎症升高。此外,在两种AD病理小鼠模型中,缺乏 Msut2 基因表现出学习和记忆缺陷减轻,神经变性减轻,病理性 tau 的积累减少。反过来,Msut2过表达增加病理性tau沉积并促进对病理性 tau 的神经炎症反应。
通过对于死亡AD病人脑组织的进一步检测,研究人员有了重大发现:来自具有较高 tau 负荷和神经元丢失增加的 AD 病人死后脑样本中 MSUT2 和 PABPN1具有“co-depletion”行为,这暗示MSUT2 和 PABPN1 可能在与 poly(A) RNA 结合的大分子复合物中共同作用。
为了验证上述猜想,研究人员先用pulldown assays 发现:MSUT2 和 PABPN1可以相互结合。随后,通过proximity ligation assay发现MSUT2 主要与 PABPN1 结合在核区室(图2)。
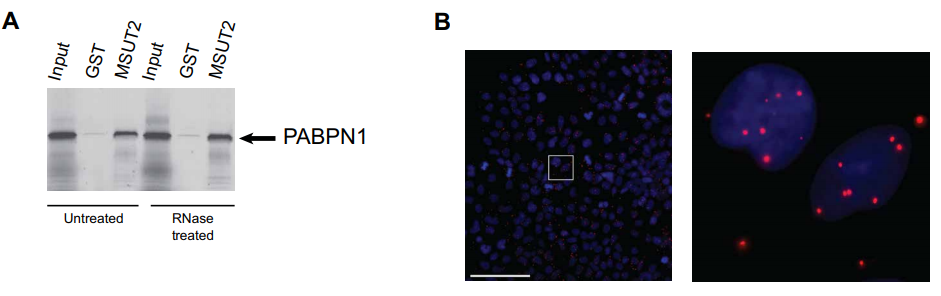
图2 pulldown assays与proximity ligation assay实验结果
以上的相关实验都是定性结果,为了更加精准地检测MSUT2 、 PABPN1与poly(A) RNA是否发生结合以及结合的动力学参数,研究人员采用Biacore进行检测,poly(A) RNA偶联到芯片,再将两个蛋白作为流动相进行检测,最终给出了“一锤定音”式的实验结论:MSUT2与poly(A)RNA 15的亲和力KD = 60 ± 15 nM ,PABPN1与poly(A)RNA15的亲和力 KD = 237 ± 21 nM(图3) 。这就意味着,三者存在多重结合。
随后,作者通过多种手段,展现了MSUT2在调控tau 聚集,病理性tau导致神经元过早死亡,加剧AD疾病严重程度等方面的作用,展现出MSUT2在信号调控及潜在药物靶点的价值。
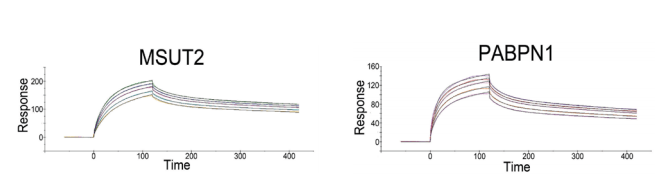
图3 Biacore检测 MSUT2 、 PABPN1与poly(A) RNA的相互作用
Aβ蛋白不同肽段自身相互作用,引发结构构象及生理功能变化
在《The Aβ(1–38) peptide is a negative regulator of the Aβ(1–42) peptide implicated in Alzheimer disease progression》研究中,一项突破性发现引起业界关注。
研究人员通过原子力显微镜,Thiofavin T 荧光,圆二色性,动态光散射等技术手段,获得了Aβ(1–38)众多新发现,这些线索暗示,Aβ(1–38)可能与不同Aβ蛋白肽段具有相互作用。为了验证该假设,研究人员首先使用Biacore 对Aβ(1–38)肽和Aβ(1–40)、Aβ(1–42)进行结合验证。作者将Aβ(1–40)、Aβ(1–42)偶联到芯片上,将Aβ(1–38)肽作为流动相,实验结果清晰显示:Aβ(1–38)和Aβ(1–40)、Aβ(1–42)具有相互作用,且与Aβ(1–40)结合能力更强(图4)。
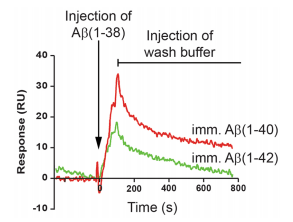
图4 Biacore验证Aβ(1–38)和Aβ(1–40)、Aβ(1–42)直接相互作用
这些观察证实,这三种肽可以在复杂的混合物中相互作用,并且 Aβ(1–38)可能会干扰 Aβ(1–40)自聚集,但可以促进Aβ(1–40)和 Aβ(1–42)之间相互作用,这些发现极大地帮助我们理解 AD 大脑中淀粉样蛋白斑块形成的基础(图5)。
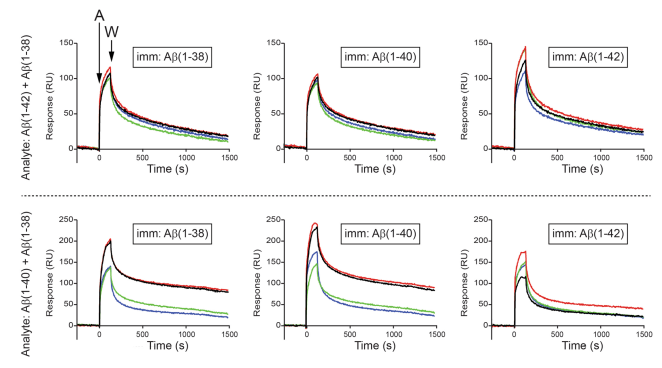
图5 Biacore验证了不同Aβ肽段相互作用及作用影响
关键性硫酸化修饰引发互作改变,协助Tau 蛋白细胞内吞
在《3-O-Sulfation of Heparan Sulfate Enhances Tau Interaction and Cellular Uptake》的文章中,首次揭示了3-O-硫酸化(3-O-Sulfation)在Tau蛋白(Tau)与硫酸乙酰肝素(Heparan Sulfate,HS)相互作用及Tau的细胞内吞过程中的关键功能。
研究人员首先通过糖阵列分析发现3-O-Sulfation增强了Tau与HS的结合。随后,为了精确表征Tau与HS的亲和力/动力学,作者利用Biacore,将猪脑,猪脊柱和猪肠来源的HS固定在SA芯片,随后以全长Tau 蛋白作为流动相,结果显示三种不同来源的HS与Tau结合的亲和力比较一致,KD约为0.02 μM(如图6)。
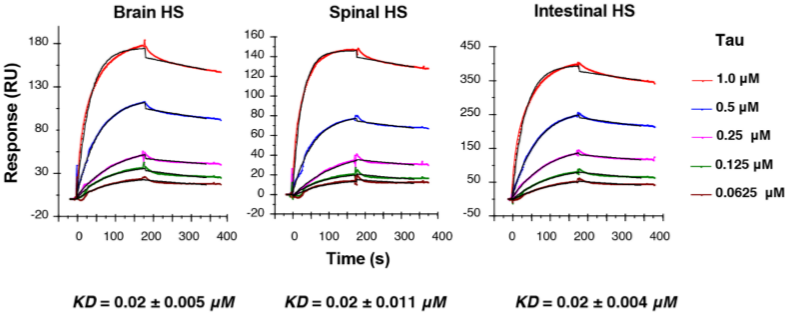
图6 三种不同来源的HS与Tau相互作用的结果
接下来,研究人员通过Biacore竞争性实验来验证3-O-Sulfation在Tau与HS相互作用中的功能。将HS偶联在SA芯片上,再将全长的Tau 蛋白分别与三个人工合成的含有不同硫酸化修饰的HS 十二寡糖( HS 12-mers ) oligo-19, oligo-20, and oligo21预先混合后流经SA芯片。
结果表明,含有3-O-Sulfation 的oligo-19 能显著竞争tau–HS的结合,并且IC50 值高达 0.9 μM。而相比 oligo-19唯一缺少3-O-Sulfation 修饰的oligo-20,其虽然也能竞争tau–HS的结合,但其竞争效果明显减弱,并且IC50 值降低了五倍,仅为 4.9 μM 。而没有任何硫酸化修饰的oligo-21则几乎完全不能竞争tau–HS的结合,其IC50 值也大于700 μM(如图7),该Biacore检测结果与糖阵列分析完全一致。这些结果表明:HS 的硫酸化对于Tau–HS的结合是必须的,并且3-O-Sulfation 能极大增强Tau–HS的结合。
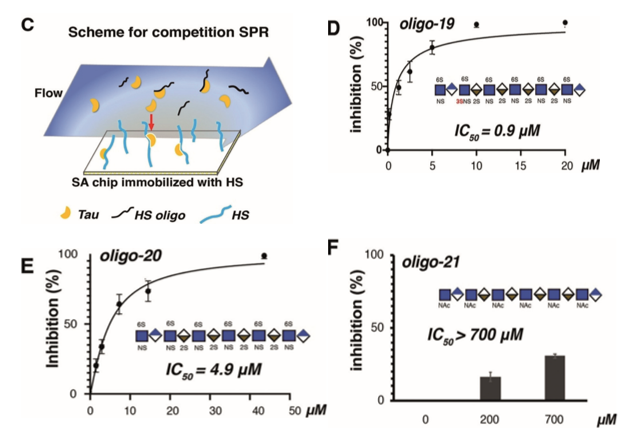
图7 Biacore竞争性实验示意图及三个 HS 12-mers与Tau 蛋白互作的检测结果
AD相关的新网络调控机制的发现
Hevin是由星形胶质细胞分泌的分泌性基质细胞蛋白,能够促进哺乳动物大脑神经回路的形成和维持,具有改变神经元之间的突触连接以及神经元迁移的作用。SPARC与 Hevin 在大脑中具有相似和相反的生物学功能,特别是SPARC能够拮抗Hevin的稳定跨突触桥的作用。MDGA 是一种膜系留蛋白,能够阻断neurexin-neuroligin跨突触桥。这三个蛋白在神经网络调控中具有重大作用,其中Hevin的作用尤为明显。Hevin通过拷贝数变异、多态性、突变和改变蛋白质水平,与普遍性神经精神和神经退行性疾病有关,例如阿尔茨海默病。
在《Interplay between Hevin, SPARC, and MDGAs: modulators of neurexin-neuroligin transsynaptic bridges》文章中,研究人员首次详细描述了这三个蛋白组成的调控网络,并细致论述了三者所扮演何种角色。
(1) 证实Hevin与neuroligins、neurexin结合
研究人员首先通过fluorescence polarization binding assay确定了FS-EC (hevin_C2) 与NLGN的结合,但是为了精确检测二者的结合能力,特别是找出Hevin结合neuroligins所需最小氨基酸序列,研究人员使用Biacore检测获得Hevin上不同氨基酸与NLGN的结合,最终确定 hevin FS 结构域含有结合所需的关键氨基酸残基序列(图8)。
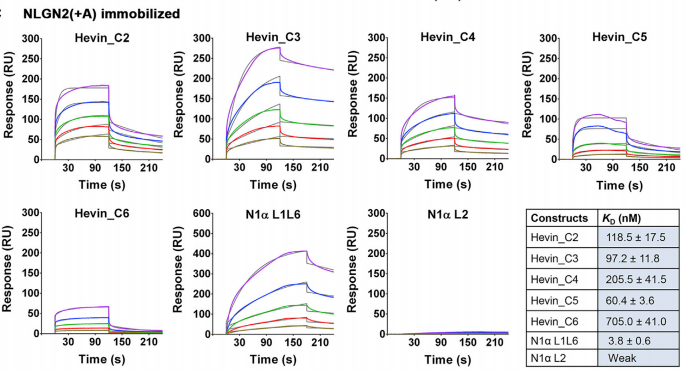
图8 Biacore检测获得不同残基与NLGN的结合
(2) 证实SPARC与neuroligins、neurexin结合
研究人员按照相同的逻辑,使用Biacore检测获得SPARC (SPARC_C1) and SPARC FS-EC (SPARC_C2) 与 NLGN2结合能力相近(图9)。通过与其他实验相结合,作者最终发现,SPARC和Hevin存在与neuroligins、neurexin竞争性结合的关系。
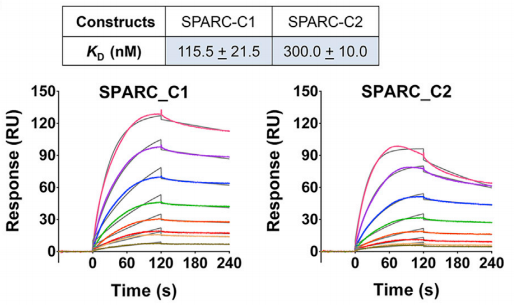
图9 Biacore检测SPARC (SPARC_C1) and SPARC FS-EC (SPARC_C2) 与 NLGN2的结合
(3) 证实Hevin 与MDGA竞争性结合neuroligin,Hevin 结合collagen V
研究人员通过实验证实Hevin 与MDGA竞争性结合neuroligin,并再次使用Biacore证实Hevin 结合collagen V(图10)。
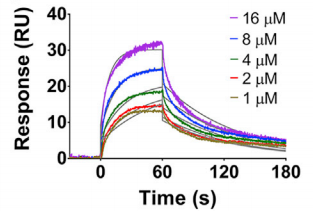
图10 Biacore证实Hevin 结合collagen V
(4) 论述这三个蛋白组成的调控网络
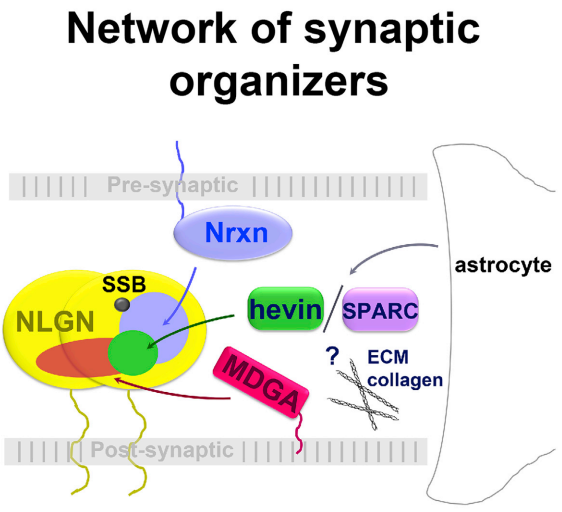
图11 新型调控网络示意图
02
Alzheimer疾病药物研发
抗体药物

图12 Aducanumab抗体药物
在《Structural and kinetic basis for the selectivity of aducanumab for aggregated forms of amyloid-β》文章中,研究人员对比不同AD抗体药物的特性(表1),其中不同抗体药物对Aβ蛋白的结合选择性,成为研究中的一个重点。
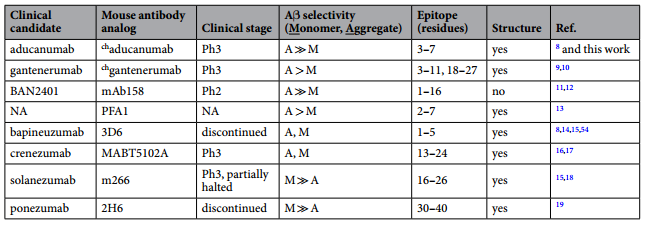
表1 不同药物属性对比表
首先,研究人员通过ELISA检测aducanumab,gantenerumab,bapineuzumab (3D6),solanezumab (m266)对于不同形式的Aβ蛋白的结合选择性,发现不同的抗体药物结合选择性相差很大(表2),例如aducanumab与Aβ1-42(纤维态)结合较强,而与Aβ1-40(可溶单体态)结合较弱;solanezumab则没有选择性。
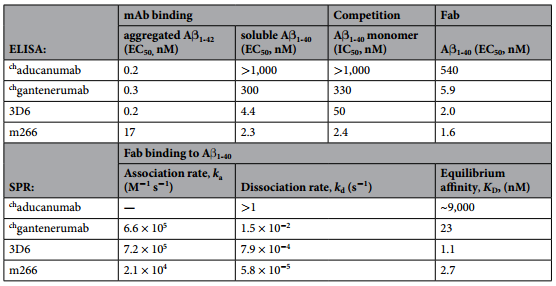
表2 ELISA与Biacore SPR方法检测不同抗体药物与单体、聚集体形式Aβ蛋白的亲和力/动力学
为了更加精准地测定四种抗体药物与Aβ1-40蛋白的结合,特别是找到结合选择性差异的机理,研究人员使用Biacore对四种抗体药物Fab片段与Aβ1-40蛋白的结合进行精确表征。
首先,从Biacore SPR传感图来看,四种抗体药物Fab片段结合特性存在着巨大差异(图13)。例如,aducanumab Fab片段属于典型的快结合快解离模式,而solanezumab Fab片段属于慢结合慢解离模式,而且解离速度极慢。
从具体数据来看,四者也具有较大差异(表2)。例如,aducanumab Fab片段对于Aβ1-40(可溶单体态)结合能力较弱,而其余三者,则结合能力很强。而其余三者中,也具有非常大的动力学差异,特别是在kd中,三者差异非常显著。
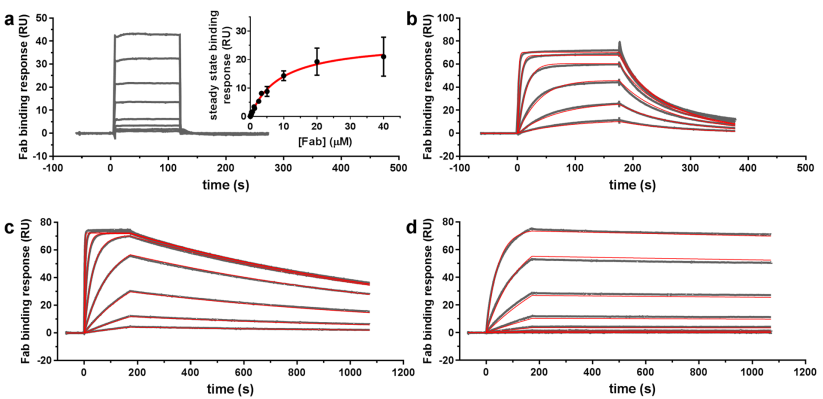
图13 Biacore SPR方法分析不同抗Aβ抗体药物Fab片段与Aβ1-40 的亲和力/动力学
多糖药物
2019年11月2日,中国海洋大学、中科院上海药物所与上海绿谷联合研发的GV-971(甘露特钠胶囊,商品名“九期一”)获批有条件上市(图14)。作为在过去十七年里在全球范围内唯一上市的治疗AD的新药,该药为广大AD患者带来了希望。该药物是以海洋褐藻提取物为原料,制备获得的低分子酸性寡糖化合物,用于治疗轻度至中度阿尔茨海默病,改善患者认知功能。而这款药物的研发与申报过程中就大量使用了Biacore。

图14 甘露特钠药物
脂质体药物
在研发治疗AD等神经性疾病药物中,有效突破血脑屏障成为一项重要课题。在《Accessing neuroinflammation sites:Monocyte/neutrophil-mediated drug delivery for cerebral ischemia》一项突破性研究发现,为治疗AD药物的研发提供了一个新的方向。
脑缺血 (CI) 是由于流向大脑的血流量不足造成的。由 CI 引起的分子传递阻碍使得药物无法有效传递至病变部位,造成了这种疾病的治疗困难。通过大量研究发现,伴随CI而至的炎症反应却为将药物递送至缺血脑和靶细胞提供了独特的机会,这是因为炎症反应可以将白细胞募集到中风核心和半暗带。也就是这个机理,研究人员突破性的将中性粒细胞和单核细胞(M/Ns)做为“特洛伊木马”,选择性携带cRGD脂质体,有效穿越血脑屏障,渗入脑实质,并将治疗分子传递到受伤部位和靶细胞。

图15 文章截图
在这研究中,有一关键环节:必须找到既能与脂质体结合又能与M/Ns特异性结合的Linker,该Linker特异与M/Ns的受体结合还能有效引发细胞内吞,从而达到通过M/Ns传递至病变部位的功能。通过大量研究,研究人员发现cRGD 肽段,其可以靶向M/Ns 上高表达的整合素αvβ1 (20),引发受体、配体、载体的内吞。因此脂质体与 cRGD 结合可优先呈递于血液 M/Ns 并被吸收到半暗带中缺血的大脑。
接下来,研究人员通过Biacore验证了cRGD与αvβ1的特异性结合。结果显示:cRGD以及cRGD聚乙二醇 (PEG)-二硬脂酰磷酸乙醇胺都可以与αvβ1特异性结合,对应亲和力分别为为1.392 × 10−7 和6.058 × 10−7 M,这表明cRGD与αvβ1有着非常高的特异性结合,并且PEG-DSPE的修饰不会对二者的结合产生明显的影响,这都表明cRGD是一个非常好的Linker。
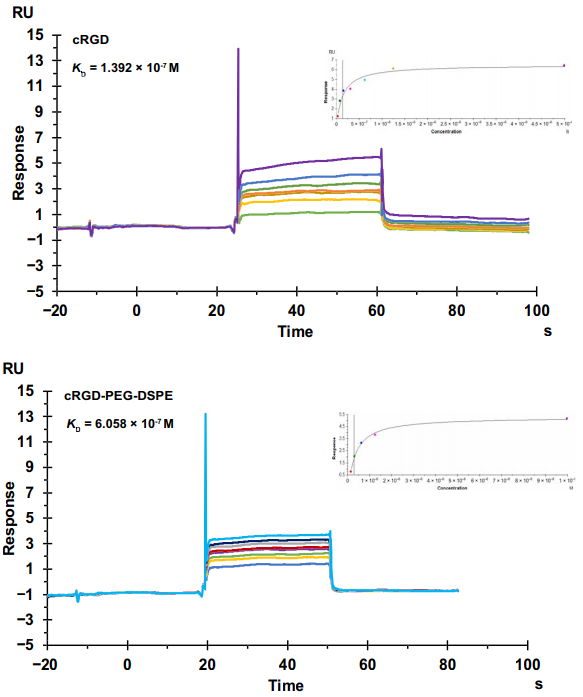
图16 Biacore检测cRGD(上)以及cRGD聚乙二醇 (PEG)-二硬脂酰磷酸乙醇胺(下)的结合
小分子药物
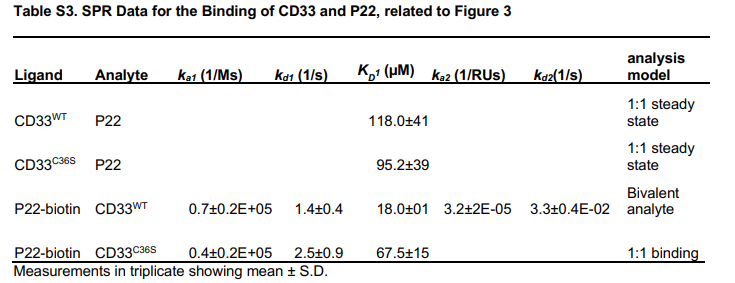
小胶质细胞受体 CD33 基因的多态性及迟发性与阿尔茨海默病有密切关系,特别是敲除 CD33 基因可以减轻淀粉样蛋白病理学特征;CD33 免疫反应性小胶质细胞的数量与 AD 脑中不溶性 Aβ42 水平和淀粉样蛋白斑块负荷呈正相关;降低CD33 唾液酸结合域的表达将具有保护功能等。因此,针对CD33靶点的抑制可能是对抗疾病的有效疗法。在《Small Molecule Binding to Alzheimer Risk Factor CD33 Promotes Ab Phagocytosis》文章中,研究人员首先获得CD33与小分子P22结合的结构,并对CD33与P22的结合结构域进行初步解析(图17)。
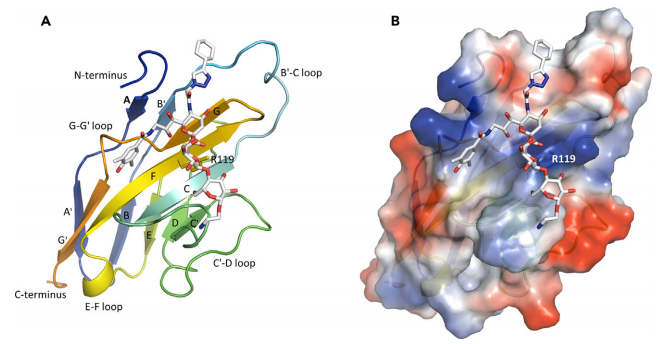
图17 CD33与小分子P22结合结构示意图
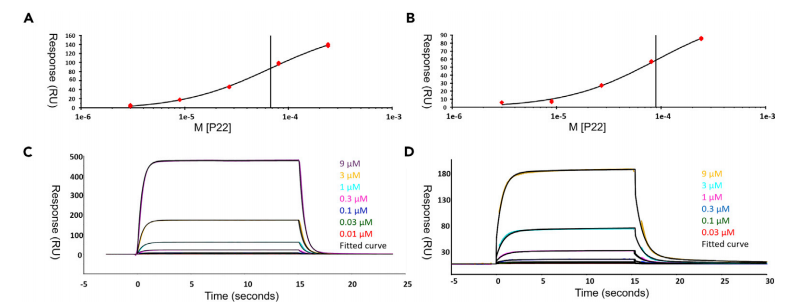
图18 Biacore检测P22与野生型CD33、突变型CD33的结合
从AD研究领域的系统性来看
从Biacore卓越性能来看
在对生物分子相互作用进行表征时,研究人员前期可能会使用不同的方法进行检测,但是最后都会用Biacore对结合结果进行“一锤定音”,这体现出Biacore的准确性与可靠性,更体现了广大研究人员对Biacore“金标准”的高度认可。
针对于蛋白、多肽、多糖、小分子、抗体等不同生物分子类型,以及快速定性检测、亲和力/动力学精确表征、分子竞争结合等,Biacore都能满足研究人员的需要,这充分体现出Biacore在应用上的全面性。
Biacore作为分子检测的金标准,30年铸就的辉煌历史与用户的信任,将成为Biacore一直向前的动力。哪怕山高路远,无论风雨泥泞,Biacore将一如既往,砥砺前行。相信,伴随着Biacore的助力,攻克Alzheimer疾病指日可待。

 收藏
收藏 询价
询价