如何助力破解恶性疟原虫与宿主共进化的博弈机制
2021年8月24日,中国疾控中心主任、中国科学院院士高福团队在Cell Reports杂志上发表了题为“Structural basis of malarial parasite RIFIN-mediated immune escape against LAIR1”的文章,从分子水平阐释了恶性疟原虫RIFIN蛋白与宿主免疫抑制性受体LAIR1分子的相互作用机制,揭示了恶性疟原虫免疫逃逸的分子机制以及宿主的反制策略,为抗疟疾药物的开发及疫苗设计提供了理论依据。
恶性疟原虫感染红细胞后可表达多种蛋白如PfEMP1、STEVOR和RIFIN等,这些蛋白表达到红细胞表面,帮助疟原虫逃避宿主的免疫监视。近年来有研究在疟疾患者体内分离到含有LAIR1胞外段片段插入的公共抗体(Public antibody),这类抗体通过插入的LAIR1片段(LAIR1Ab)识别被感染红细胞表面表达的RIFIN蛋白。插入的LAIR1Ab片段均出现不同突变。LAIR1是一种在NK细胞、T细胞等多种免疫细胞表面表达的免疫抑制性受体。RIFIN蛋白是目前已知的恶性疟原虫中最大的多变抗原家族,每个疟原虫基因组编码150-200个rif基因。这些RIFIN成员如何与LAIR1结合,而有LAIR1Ab片段插入的抗体如何发挥作用是亟待解决的科学问题。
来自中国疾控等单位的研究团队通过解析RIFIN的单体结构以及两个RIFIN成员与LAIR1/LAIR1Ab的复合物结构,系统研究了RIFIN-LAIR1相互作用介导的恶性疟原虫免疫逃逸机制及宿主的反制策略。RIFIN蛋白胞外段由保守区(Conserved region, CR)和可变区(Variable region,VR)组成,研究发现其通过可变区识别LAIR1,可变区形成以α螺旋和柔性区为主的类似瞭望塔的结构,利用顶部的两个柔性loop和一个α螺旋与LAIR1结合。两个RIFIN成员均靶向LAIR1上相似的结合区域,但结合的角度不同,表明RIFIN不同成员由于序列多样性具有很强的结构可塑性。研究进一步比较了RIFIN与LAIR1或LAIR1Ab的相互作用细节,揭示了抗体插入的LAIR1Ab突变增强亲和力的分子机制。
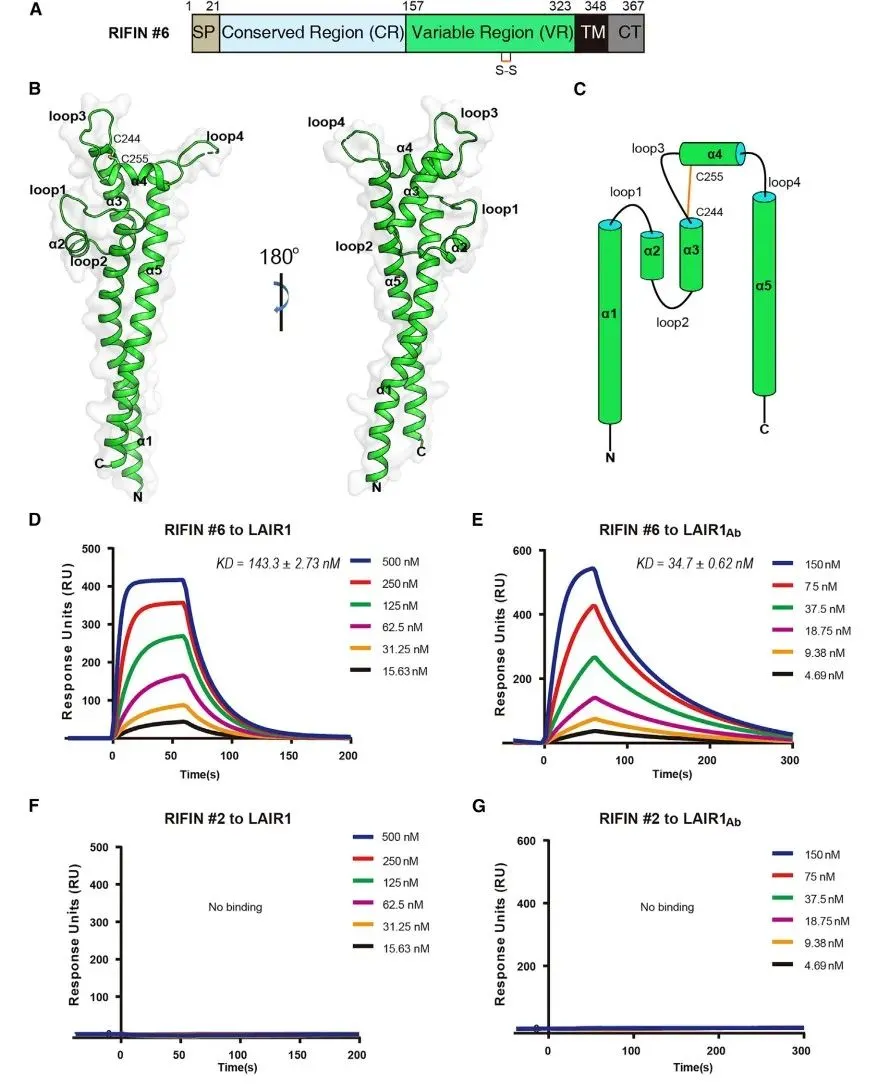
图1 RIFIN蛋白三维晶体结构
有意思的是,RIFIN与LAIR1的结合位点与LAIR1与其天然配体胶原蛋白(Collagen)的结合位点部分重合外,有研究报道另一种免疫抑制受体LILRB1也可与被感染红细胞表面表达的RIFIN蛋白结合,从而抑制免疫细胞的功能。比较发现,RIFIN成员使用不同的结合位点与LAIR1或者LILRB1进行结合,这一现象进一步表明RIFIN家族成员的多样性。表明RIFIN可能通过模拟胶原蛋白与LAIR1结合进而抑制免疫细胞的功能。
另外,通过LAIR1-NFAT-GFP报告系统发现RIFIN-LAIR1相互作用可引起LAIR1受体下游的信号活化,而有LAIR1Ab插入的公共抗体,如MGD21、MGM5,可阻断RIFIN引起的LAIR1下游信号的活化,作者在研究中通过Biacore检测发现 MGD21 与 RIFIN #6-VR 结合的亲和力远高于 MGM5(0.25 nM vs 476.3 nM,图2)。通过分析LAIR1和两个抗体的序列,发现除了T67L/N69S/A77T突变外,MGD21与生殖系LAIR1相比还包含其他几个突变,而MGM5与生殖系LAIR1相比仅包含I102A突变。这揭示了疟原虫利用RIFIN蛋白和免疫抑制性受体LAIR1相互作用从而实现免疫逃逸,相反,为了应对疟原虫的感染,宿主产生有LAIR1Ab插入的公共抗体阻断RIFIN-LAIR1相互作用。
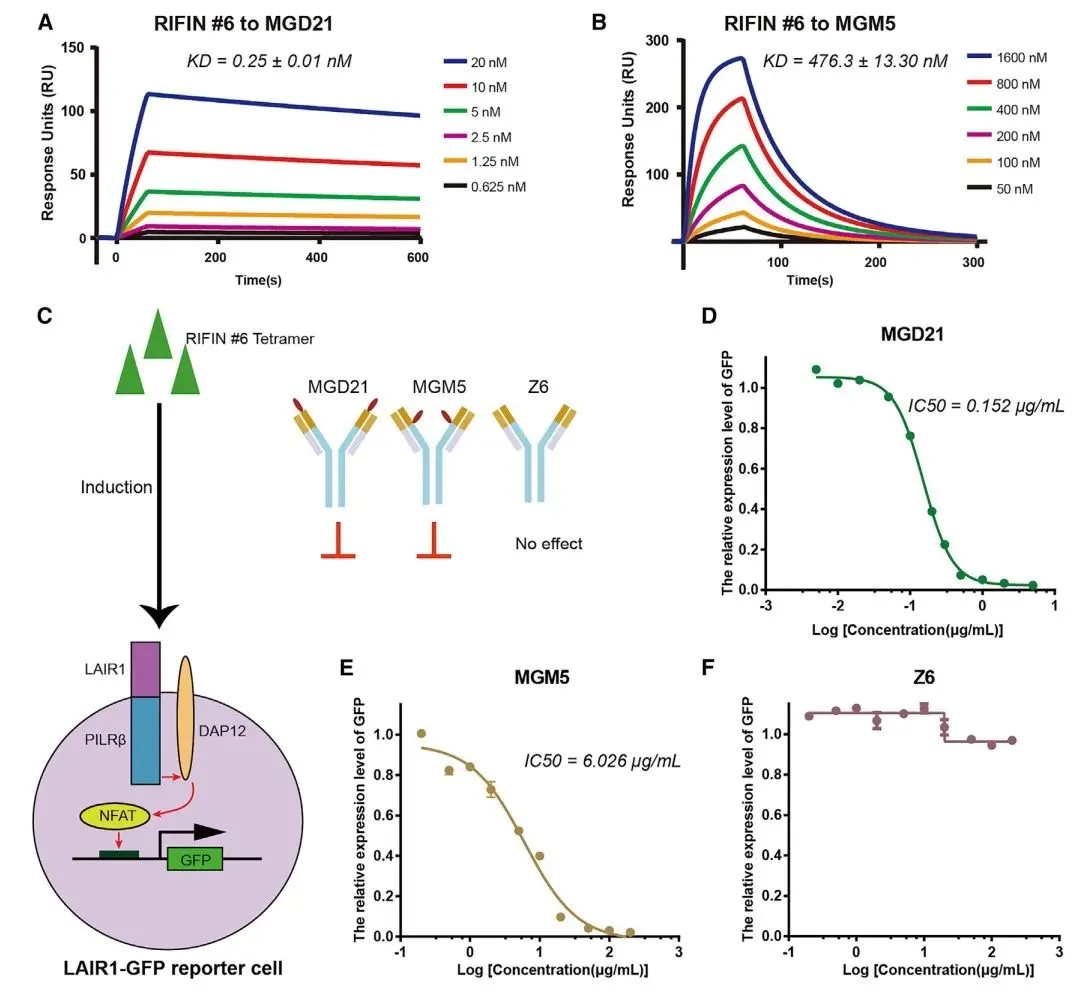
图2 LAIR1Ab插入的公共抗体可阻断RIFIN介导的免疫逃逸
Biacore
for your better life!

 收藏
收藏 询价
询价