Biacore检测蛋白与小分子相互作用的常见问题(上)
不管是在药物研发还是基础科研中,检测蛋白与小分子的相互作用都是一类重要的实验。小分子最主要的特点是分子量较小,一般在1000 Da以下;并且结构性质各异,部分溶解度较差,需要使用有机溶剂(例如DMSO等)促溶;这些特点给相互作用的检测带来很大的挑战。基于SPR(表面等离子体共振)原理的Biacore系统具有灵敏度高、可进行溶剂校正等优势,不仅可以检测较低的信号,且对分子量差异悬殊的互作类型也能精确检测,同时还能消除有机溶剂带来的影响,因此越来越多的研究者选择Biacore进行蛋白与小分子相互作用检测。
我们将根据智荟专线收集到的客户反馈,针对Biacore系统检测蛋白与小分子相互作用实验中常出现的代表性问题,分上下两篇进行简单的分享与讨论。本篇为上篇,将主要围绕实验设计和样品准备方面的问题展开介绍。
一、配体的固定策略以及芯片的选择

对于上面的核心方程式有了基本的了解之后,就可以回答下面这些问题了。
1
是选择固定蛋白还是固定小分子?
综上所述,固定蛋白的过程相对简单也适用于大多数结合反应,因此是目前探究蛋白与小分子互作时最常用的选择。
2
固定蛋白是选择直接偶联还是捕获法?
直接偶联(氨基偶联)法的操作方法较简便、明确,而且可以实现较高的偶联量,在小分子作为分析物时,有利于获得比较理想的响应值。例如常用的CM5芯片,最高偶联量可以到10000 – 15000 RU,非常适合蛋白与小分子此类分子量差异悬殊的检测。除了直接偶联法以外,根据样品性质与分子量差异,捕获法也是一种您可以选择的固定策略,例如:待固定的样品未经纯化,含有其他杂质;或者担心直接偶联的过程会影响结合位点等。在这些情况下,可以考虑通过捕获法固定配体。当配体样品的纯度不够时,捕获的过程相当于在芯片表面进行了一次在线纯化;捕获过程的条件较为温和,可以尽可能地保留配体的结合活性,同时保证配体自由朝向,充分暴露结合位点。
常用的捕获类芯片以NTA芯片为例,这是一种可以通过螯合镍离子捕获带有His标签蛋白的捕获芯片。如下图1所示,NTA芯片上捕获量大约在3000 – 4000 RU[1]最为稳定,非常适合His标签蛋白与小分子二者分子量差异不是特别大的亲和力检测。
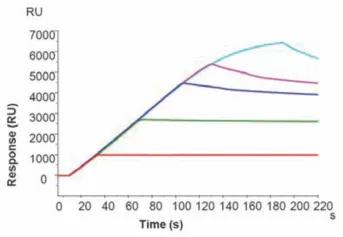
图1. 在NTA芯片上,不同捕获量水平下基线的稳定情况[1]。
3
氨基偶联蛋白配体是选择CM5芯片还是CM7芯片?
CM5与CM7芯片表面均为羧甲基化修饰的葡聚糖基质,两者最主要的区别是CM7芯片的羧基含量显著高于CM5芯片,因此可以实现更高的偶联量。图2比较了三对蛋白与小分子的互作在CM5和CM7芯片上的结果差异,可以看到同一组互作实验,在CM7芯片上可以达到的偶联量和分析物响应值为CM5芯片的3倍以上 [2] 。
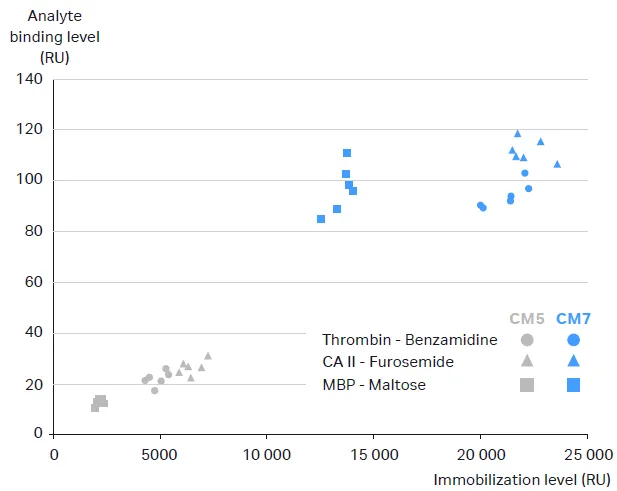
图2. 三组蛋白与小分子互作在CM5和CM7芯片上的偶联量与分析物响应值比较[2]。
二、样品准备的相关问题
1
如何选择运行缓冲液?
在选择运行缓冲液时,并没有明确的规定必须使用何种缓冲液,应该根据分子互作的自身性质选择合适的缓冲液。一般来说,有以下经验可供参考:当分析物是小分子的情况下可以首先尝试PBS 或者PBS-P+缓冲液;而分析物为蛋白时可以首先尝试HBS或者HBS-EP+缓冲液。
在一些情况下,小分子的溶解需要一定浓度的有机溶剂助溶,例如5% DMSO等,而这些有机溶剂在不同样品之间的浓度差异会干扰响应值信号,因此需要对这部分由运行缓冲液造成的信号进行校正——溶剂校正。而有机溶剂自动校正的功能,也是Biacore的绝活儿之一,充分保证了最终实验结果真实可信。关于溶剂校正的相关问题将在下篇中进行讨论。
2
需要准备多少的蛋白用来偶联?
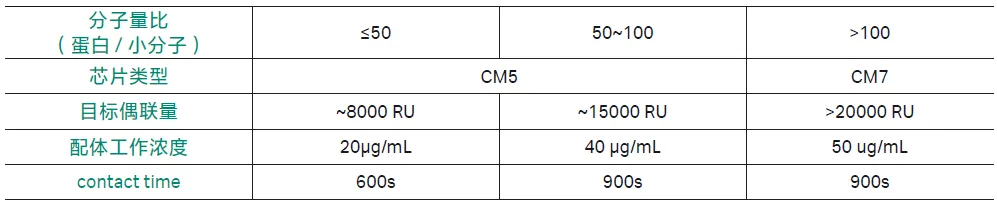
表1. 偶联量与配体工作浓度参考表[3]。
3
小分子分析物的浓度范围如何确定?
以上是针对Biacore检测蛋白与小分子互作的实验方案设计以及样品准备方面的常见问题分享。良好的开端是成功的一半,合理的活性配体偶联量、分析物浓度范围以及运行缓冲液选择,将帮助我们得到更理想的实验结果。在下篇中我们将继续分享关于实验进行以及数据分析方面的常见问题,敬请期待!
参考文献:
[1] Series S Sensor Chip NTA Instructions for Use, 22060737 AI V:8 07/2020. [2] Sensor Chip CM7 Series S Sensor Chip CM7, CY14426-10Sep20-DF. [3] Easy Biacore: T200 检测蛋白与小分子结合. [4] Kinetics and affinity measurements with Biacore systems, CY12854-21Jan21-HB.
 收藏
收藏 询价
询价