助力攻克重症医学难题 —— Biacore在脓毒症机理研究与药物开发中的应用
在革兰氏阴性细菌感染过程中,细菌来源的内毒素(LPS)能引起组织因子的表达与活化,从而快速启动凝血反应,形成血管内血栓并阻止细菌通过血循环进行传播。但当细菌大量侵入血循环造成全身性重症感染(脓毒症)时,失控的凝血反应将发展成为弥散性血管内凝血(disseminated intravascular coagulation,DIC)。DIC 表现为凝血因子的全身性激活,以及全身微小血管内的广泛血栓形成、微循环障碍、最终导致多器官功能衰竭。
然而,脓毒症休克和多脏器衰竭的发病机理尚不清楚,目前在临床上治疗脓毒症的手段也非常有限。因此探索脓毒症致死的关键机制是当前国际重症医学领域的前沿热点,并具有重大的临床价值。
中南大学湘雅三医院吕奔教授团队围绕脓毒症的发病机理及靶向干预开展了系列研究,揭示了脓毒症重要的致病机制,为脓毒症的诊治提供了潜在的生物标志物和药物干预靶点,并针对该靶点进行药物筛选,为今后脓毒症的防治提供了新的思路。
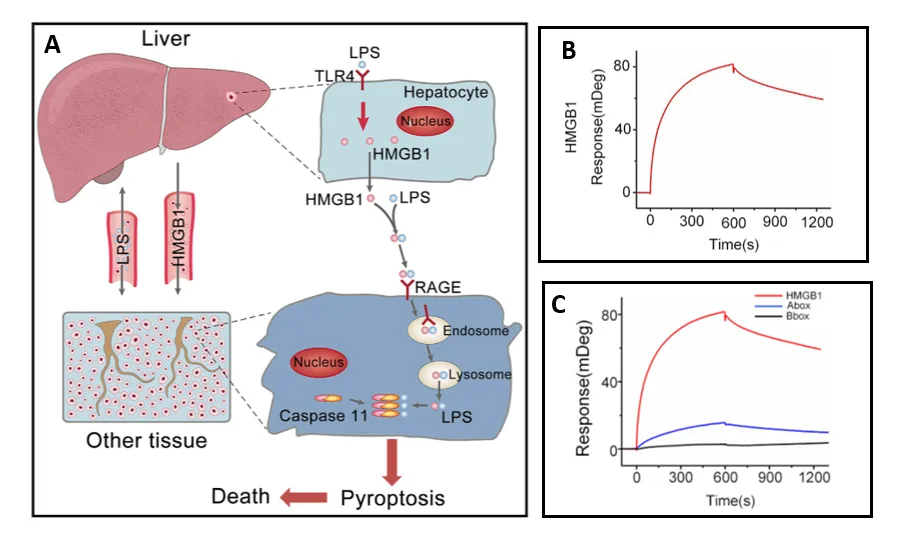
研究发现肝脏细胞在脓毒症中能向血循环释放大量的高迁移率蛋白-1(HMGB1),这种蛋白能够与血循环中的 LPS 结合,并通过血管内皮细胞和巨噬细胞上的 RAGE 受体将细菌内毒素高效转运至胞浆中(图 1-A)。在整个过程中作为分子伴侣的 HMGB1 蛋白与 LPS 结合,是启动下游过程的关键性步骤,在这个研究中,研究人员利用 Biacore 直接在分子水平上呈现了这一过程,得到了 HMGB1 与 LPS 结合的实时传感图(图 1-B)。
进一步分析 HMGB1 蛋白的结构发现,其存在两个结合 LPS 的结构域 A-box 和 B-box,通过 Biacore 实验发现,截短的 HMGB1 蛋白(仅包含 A-box 或仅包含 B-box)均不能和 LPS 结合(图 1-C),因此这两个结构域都是 HMGB1 蛋白结合 LPS 所必须的。
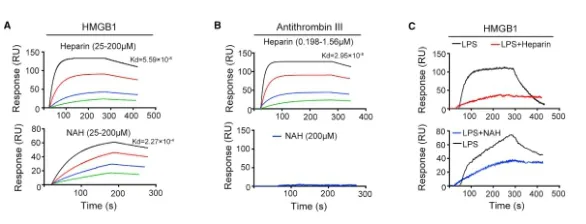
肝素是一类分子量大小不同的内源性多糖分子的混合体。其中部分多糖分子具有与抗凝血酶等凝血调节蛋白结合的能力,并发挥抗凝作用,是临床上常用的抗凝药物,但在使用时具有出血风险。因此,该研究中同时探索了肝素和无抗凝活性肝素(non-anticoagulant heparin,NAH,化学修饰后的肝素,无出血风险)治疗脓毒症的差异。Biacore 实验表明,改造后的 NAH 确实不能与抗凝血酶Ⅲ反应,失去抗凝血功能(图 2-B)。
他们在研究过程中发现:肝素并不是直接靶向 Caspase-11,而是通过与 HMGB1 结合,阻断 LPS 的胞浆内转运,从而抑制 Caspase-11 活化。Biacore 实验结果表明,肝素和无抗凝活性肝素 NAH 均能与 HMGB1 结合(图 2-A),后续的竞争实验也表明肝素以及 NAH 与 HMGB1 的结合确实阻断了 LPS 与 HMGB1 形成转运复合物(图 2-C)。
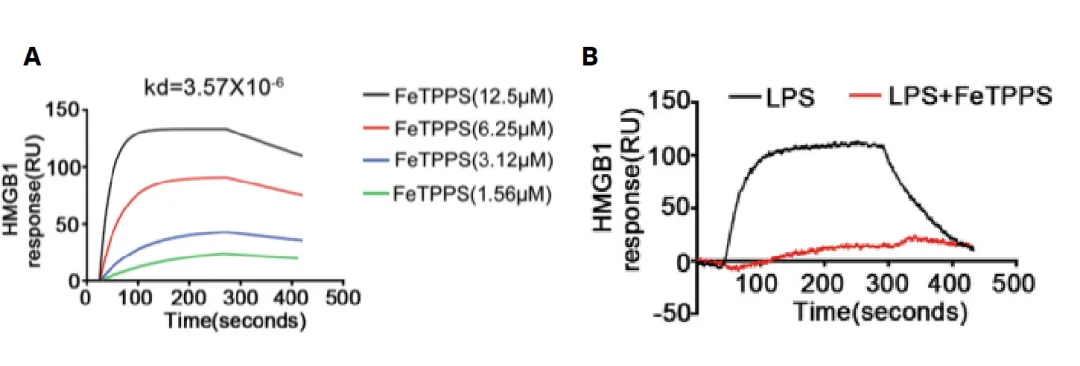
在这个研究中,研究人员使用 Biacore 对 FeTPPs 与 HMGB1 的结合进行了验证(图 3-A)。更是通过设计竞争实验,直观地表明 FeTPPs 的分子作用机制是阻断了 HMGB1 与 LPS 的结合(图 3-B),从而抑制了 LPS 的胞质内转运,起到了治疗脓毒症的作用。
综合上述研究结果,我们可以看到从脓毒症的机理研究,到相关治疗药物的开发,Biacore 都提供了大量的数据,涉及的实验类型除了提供分子间的亲和力和动力学数据,还通过竞争实验直观地看到了肝素,包括无抗凝活性肝素 NAH,以及小分子抑制剂 FeTPPs 作为脓毒症的先导药物发挥作用的分子机制。
在这些研究中涉及多种样本类型,包括蛋白,糖类和小分子。这充分展现了 Biacore 应用范围的广泛性。在分子互作研究中,小到离子大到完整的细胞,无论是纯品亦或是血清、腹水等复杂的临床样品,几乎所有的生物样本都可以在 Biacore 上轻松进行检测,不愧是分子互作界的「金标准」与「多面手」,绝对是开展疾病机理研究和药物开发的不二之选。
Biacore,
for a better life

 收藏
收藏 询价
询价