小身材,大用途 | Biacore X100在破伤风毒素中和抗体研究中的应用
为防止伤口接触破伤风梭菌的潜在风险,需要进行抗毒素治疗。目前马源抗TeNT抗体由于血清病和过敏症的风险,已不在工业化国家使用。尽管抗TeNT人源免疫球蛋白(TIG)更为有效和安全,但它有潜在的血液传播病原体的风险,而且在发展中国家比如中国常常供不应求。所以,亟需一种安全高效的抗TeNT治疗性单抗,用以替代马源抗TeNT抗体和人血清TIG,预防和治疗破伤风梭菌感染。
TeNT有1315个氨基酸,分为A,B,C三个功能片段。50KD的N端轻链(片段A)与100KD的C段重链通过二硫键连接。片段A是毒素的活性部位,有金属蛋白酶活性。片段B是重链的N端部分,负责毒素转运。片段C位于重链C端部分,结合神经元上受体。
2021年5月,暨南大学生命科学与技术学院廖化新课题组在Cell Reports上发表文章。研究者从反复破伤风类毒素疫苗接种的志愿者血液中分离得到32个TeNT特异性天然人源单抗。通过动物实验和ELISA、Biacore等互作手段,最终得到4个潜在TeNT中和单抗,非常有希望开发为治疗性抗体。
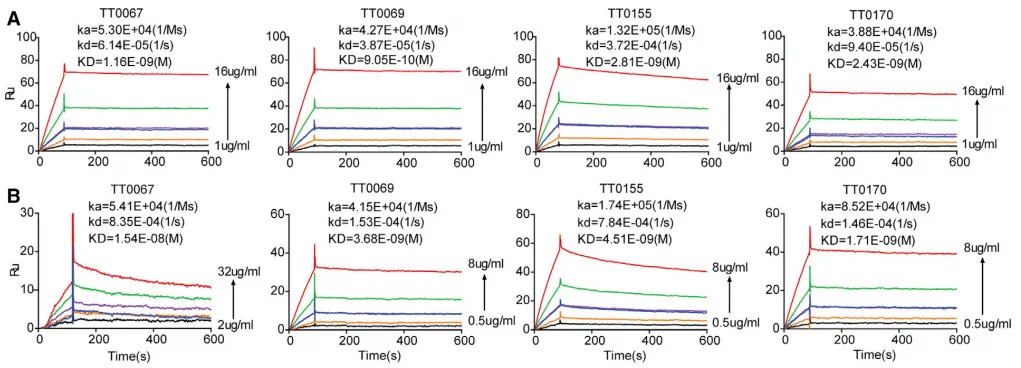
研究者通过Biacore实验证明4个潜在的中和抗体在结合TT疫苗抗原的同时,也能结合WT TeNT。由于抗体结合TeNT或TT的亲和力很高,难以解离和再生,作者改用了捕获法。与直接偶联的方法相比,捕获法无需优化再生条件,更加方便快捷。使用人抗捕获试剂盒(BR100839),在CM5芯片上偶联anti-human Fc IgG 6000RU,在2通道捕获单抗200RU,1通道作为参比,流过倍比稀释的TT或TeNT的浓度梯度,30 μL/min进样90s,解离600s,使用3M MgCl2进样30s再生。
结果表明,TeNT以nM级的高亲和力结合所有4个抗体(图1A),相较TT亲和力相似或者更高(图1B)。尤其是TeNT结合TT0067的亲和力KD为1.16×10-9 M,解离速率kd为6.14×10-5 1/s,而TT以更弱的亲和力KD=1.54×10-8 M,更快的解离速率kd=8.35×10-4 1/s结合TT0067(图1A和1B)。
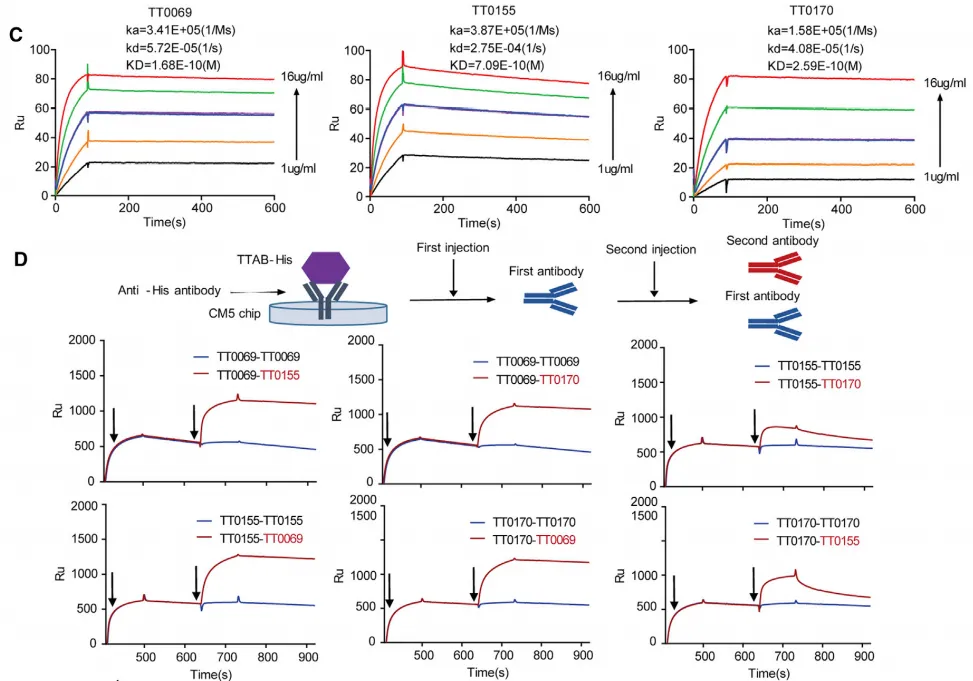
随后,作者使用Biacore研究了3个结合片段AB的中和抗体的阻断竞争关系。使用His捕获试剂盒(28995056),将anti-His tag抗体偶联在CM5芯片,通过His6-Tag捕获片段AB,依次进样两个抗体(图2D)。结果表明,单抗TT0069对片段AB的结合不会被TT0155或TT0170阻断,反之亦然。而TT0155和TT0170可以部分阻断彼此对TeNT的结合(图2D)。
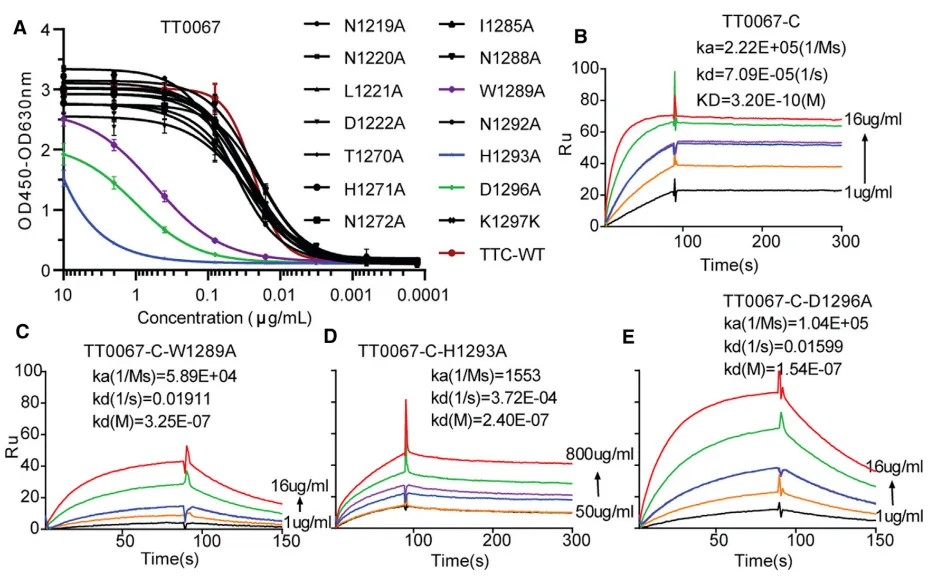
结果与复合物结构分析一致:W1289通过疏水作用与TT0067的HCDR1互作,通过范德华力与HCDR3互作;H1293通过盐桥与HCDR3互作;D1296通过氢键与HCDR1和HCDR2互作;三个残基突变成丙氨酸后,片段C与TT0067的亲和力均降低了500-1000倍(图3)。
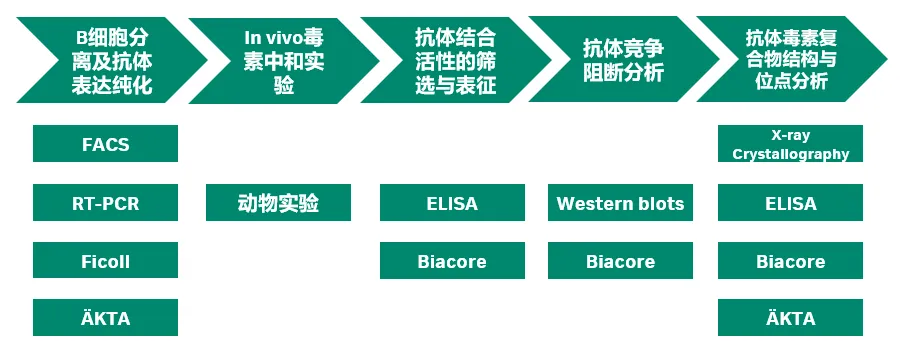
接下来使用小鼠进行in vivo毒素中和实验,得到中和效果最好的4个抗体。使用Biacore X100表征了抗体与TT和TeNT的结合活性。对于3个结合片段AB的抗体,使用Biacore X100研究了抗体与片段A的结合活性及抗体间竞争阻断的关系。对于结合TeNT片段C的抗体TT0067,通过纯化共结晶解析了复合物的晶体结构,分析互作的关键位点,使用Biacore X100验证了关键位点对于相互作用的影响。
这套成熟的实验流程已运用在多个中和抗体项目的研究(见扩展阅读)。总结来说,Biacore X100在抗体活性表征,竞争阻断分析,关键结合位点分析中均提供了核心数据。

 收藏
收藏 询价
询价