重磅获批,双管齐下,Biacore助力眼科药物进入多靶点时代
罗氏制药双特异性抗体 Vabysmo(faricimab-svoa)在日本获得批准,之前其获得美国食品药品管理局(FDA)批准时就引起了广泛关注。Vabysmo用于治疗新生血管性或“湿性”年龄相关性黄斑变性(nAMD或wet AMD)和糖尿病黄斑水肿(DME),这两种疾病是美国成年人视力丧失的主要原因。Vabysmo代表着眼科向前迈出的重要一步, 它是首款获FDA批准用于眼部的双特异性抗体。
首个眼内治疗双抗药
Vabysmo是一种旨在靶向驱动视网膜疾病的2个独特信号通路的药物,其活性药物成分faricimab是首个专门为眼睛设计的双特异性抗体。与目前抑制VEGF通路的DME和nAMD治疗方法不同,faricimab靶向2种不同的途径 — 通过血管生成素-2(Ang-2)和血管内皮生长因子A(VEGF-A),这2种途径可驱动多种视网膜疾病,包括nAMD和DME。Ang-2和VEGF-A通过破坏血管稳定性、导致新的渗漏血管形成、并增加炎症反应,从而导致视力下降。通过同时阻断这2条途径,faricimab旨在稳定血管,并比单独抑制任何一种途径更能减少炎症和渗漏。这可能比单用抗VEGF疗法更能改善视力,进而减少所需的眼部注射频率。
faricimab设计基于150 kDa人IgG1的框架生成了双特异性CrossMAb RG7716,faricimab (RG7716)由两个不同的重链和两个不同的轻链组成。一个配体结合臂结合VEGF-A,另一个结合ANG-2。其Fc区域经过适当的修饰和优化,优化后faricimab不但可与VEGF-A和ANG-2高亲和力结合,而且与ANG-1无结合,是非常适合后续眼科临床开发的分子。
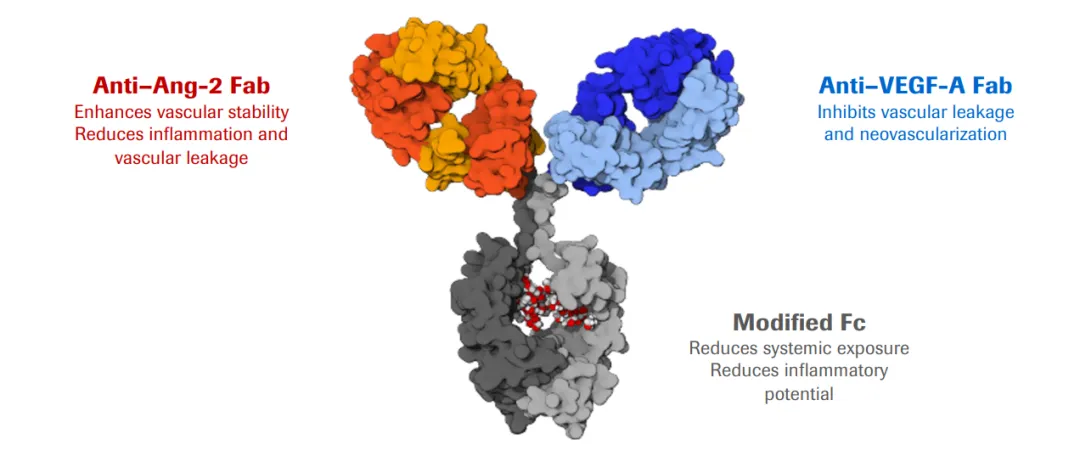
图1 faricimab (RG7716)的结构展示
实验人员运用Biacore T200,将RG7716通过芯片表面上的抗Fc抗体捕获固定。如图2所示,在绿色传感线所代表的实验中,先注入了第一段ANG-2然后注入第二段VEGF-A,比较他们的结合趋势。红色传感线显示了相反进样顺序的结合测试结果。两次实验结果均显示,其中任何一个抗原与faricimab (RG7716)的结合都不会影响该双抗与另一个抗原的结合。通过Biacore证明了faricimab (RG7716)能同时结合ANG-2和VEGF-A。
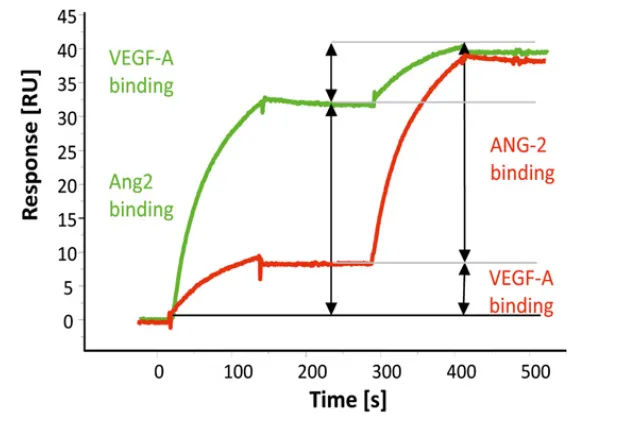
图2 Biacore检测双特异性抗体faricimab (RG7716)与Ang2/VEGF-A的结合
faricimab (RG7716)是一种全人源双特异性抗体,能够与VEGF-A的所有亚型结合,同时与ANG-2结合而不与ANG-1结合,并具有修饰的Fc区域,改造后的抗体与野生型IgG1抗体相比可提高疗效,提升眼内持久性,保证快速系统清除。并且通过优化Fc区,减少全身暴露和潜在的促炎反应。科研人员通过Fc区域的工程优化 faricimab (RG7716)用于视网膜适应症, Fc区域被设计为消除与所有FcγR和FcRn的结合。为了证明RG7716与相应的人Fc受体的结合丧失,将FcγRIa,FcγRIIa,FcγRIIIa和FcRn蛋白固定在SPR传感芯片上,流经RG7716与对照抗体。Biacore实验结果显示,改造后的RG7716与FcγR和FcRn均不结合。
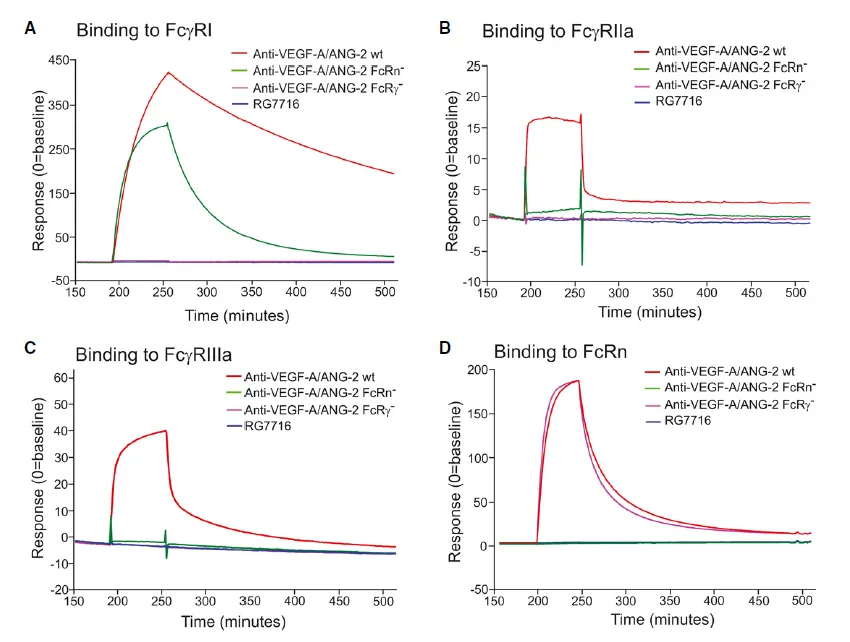
图3 RG7716与FcγR和FcRn的结合曲线
罗氏制药眼科多重护城河
罗氏围绕VEGF治疗AMD等眼病,构建了多重护城河,包括VEGF/Ang2双抗、雷珠单抗PDS给药系统。同时罗氏在开发下一代双特异性抗体类型,基于Dutamab兼容PDS系统的VEGF/Ang2双抗VEGF/PDGF双抗。这些携带可变区片段的双特异性抗体(DutaFab)的分子量显著小于传统的双特异性抗体。这意味着更高剂量的药物能够被装在药物递送系统中,从而进一步延长疗法的持久性。
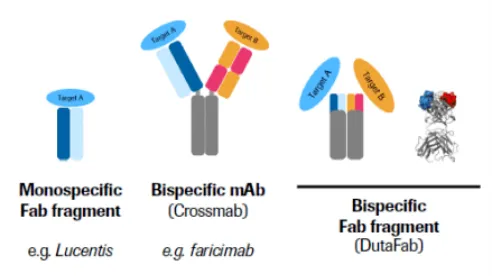
图4 DutaFab的结构示意图
DutaFab技术平台是罗氏2014年收购Dutalys时获得。DutaFab为一个杂合的可变区,类似于Fab,但CDR区杂合形式为H1/H3/L2和L1/L3/H2,该可变区可以同时结合两个靶点,为一种巧妙的“2 in 1”结构。基于DutaFab技术平台,罗氏研发了VEGF/PDGF双抗和VEGF/Ang2双抗。在他们2021年披露的数据中X射线晶体结构表明,DutaFabs能够在包含VH-VL异源二聚体的同一Fv区域同时结合两个目标分子。随后采用Biacore进行的SPR实验证实了两个靶标与同一DutaFab分子的高亲和力共结合。正如DutaFab概念中所期望的那样,所有设计用于参与H侧结合位的CDR都与PDGF-BB接触,并且所有3个设计用于参与L侧结合位的CDR与VEGFA-121接触。
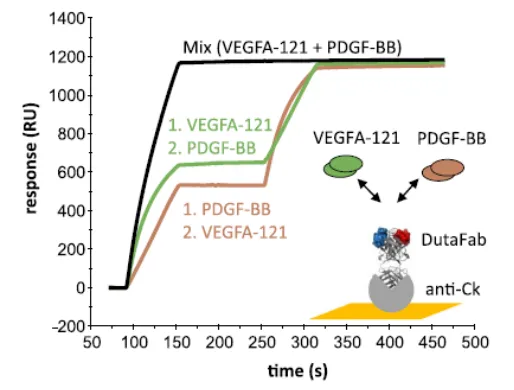
图5 采用Biacore证明DutaFab可同时结合于两个抗原
IBI302 全球首个靶向 VEGF 和补体的双特异性融合蛋白
放眼国内市场,目前已批准的抗 VEGF 抗体药物均为单特异性抗体,国内眼科 VEGF 抗体药物市场,正在迎来越来越多的全新竞争者。信达生物制药在去年宣布,其全球首创眼科抗VEGF-补体双靶点药物(研发代号:IBI302)的II期临床研究完成首例患者给药。IBI302 是信达生物制药自主研发的抗 VEGF 以及抗补体双靶点特异性重组全人源融合蛋白:N 端能够与 VEGF 家族结合,阻断 VEGF 介导的信号通路,抑制血管内皮细胞的生存、增殖,从而抑制血管新生,降低血管渗透性,减少血管渗漏;补体激活相关的慢性炎症反应是 AMD 发病早期关键机制,IBI302的C 端能够通过特异性结合 C3b 和 C4b,抑制补体经典途径和旁路途经的激活,减轻补体介导的炎症反应,从而达到治疗和控制 AMD 的目的。
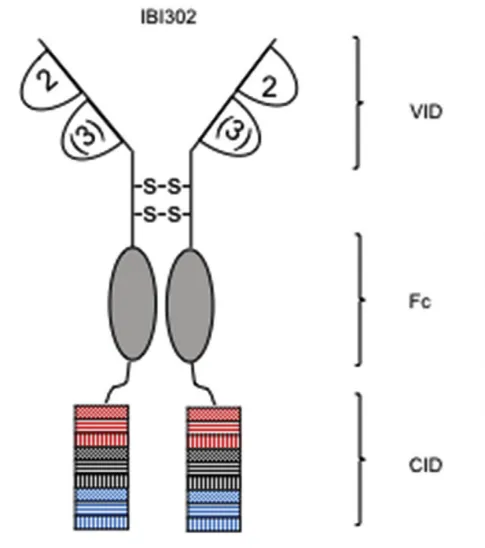
图6 信达IBI302的结构示意图
在2016年发表于Experimental Eye Research的研究中,作者利用表面等离子共振(SPR)技术系统地评估了IBI302与VEGF亚型和补体蛋白之间的结合亲和力。SPR测定结果表明,IBI302可以结合不同的VEGF亚型并且与补体蛋白具有高亲和力(表1)。作者使用Biacore检测了IBI302,阿非贝西普(Aflibercept)及贝伐珠单抗(Bevacizumab)与VEGF各亚型的结合亲和力。数据表明, IBI302表现出与广泛使用的AMD药物同样高,甚至更高的结合亲和力。IBI302和CR1对补体蛋白的结合亲和力数据表明,IBI302对C3b和C4b具有很高的亲和力。由于C3b和C4b是所有补体途径中的重要介质,因此IBI302被认为可以抑制CCP和ACP。进行溶血测定以确认IBI302的抗补体活性。CCP和ACP均具有高抑制活性。随后研究了IBI302的生物活性。IBI302对人原代脐静脉内皮细胞增殖和体外补体途径的激活具有抑制作用。最后,在恒河猴中评估了IBI302的药代动力学(PK)特性。PK结果显示,在玻璃体内注射0.5mg/眼后,IBI302从玻璃体迅速分布到靶向组织中,并在504小时内保持活性。
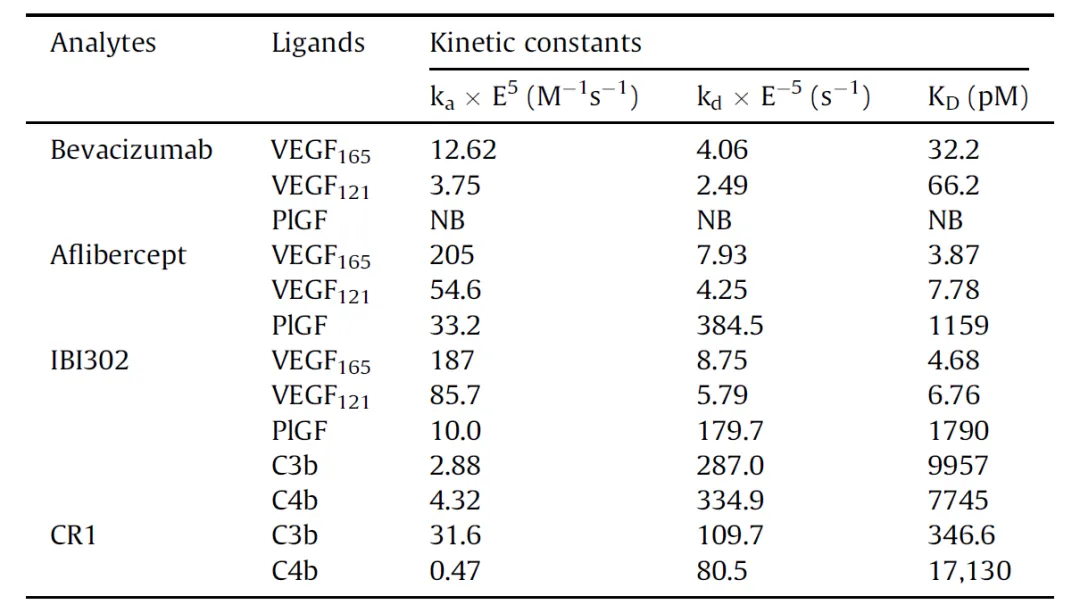
表1 IBI302和对照抗体的动力学常数。
目前 IBI302 针对湿性年龄相关性黄斑变性和糖尿病黄斑水肿这两个适应症启动了 4 项临床,最高进展至临床 II 期。
总结
抗血管内皮生长因子(anti-VEGF)药物正式上市并应用于临床的时间已超过10年。在此期间,anti-VEGF药物依赖其切实可靠的临床疗效,得到了眼科业内广泛的认可,并对眼科及其他相关医疗行业的发展起到了巨大的推动作用。
Vabysmo(faricimab-svoa)作为第一个被批准用于眼部治疗的双特异性抗体,标志着nAMD和DME的重大进步,可根据患者需要提供灵活的给药方案。眼科药物也正式进入多靶点时代。与当前标准护理相比,Vabysmo通过更少的注射频率,降低治疗负担。在眼科药物的发展过程中随处可见Biacore的身影。
Biacore作为中美日三国药典收录的分子互作技术,在治疗药物开发和质控领域有着大量的应用,在抗体的结合活性、活性浓度、热稳定性等检测和研究中发挥了巨大作用。Biacore设备符合GxP和21 CFR Part 11的合规要求,它的高准确性、高灵敏度、高重复性的性能表现满足了药物研发相关的法规要求,在药物研发和致病机制研究中引领着潮流。

 收藏
收藏 询价
询价