药物研发加速器:Biacore助力STING抑制剂的发现
肿瘤免疫领域的靶点纷纷成为诸多药企追踪的“明星靶点”,而STING(干扰素基因刺激蛋白)靶点便是其中之一。全球各大药企均已加入STING赛道。2021年4月,成都先导药物开发股份有限公司开发的注射用HG381的临床试验申请获得国家药品监督管理局批准,临床拟用于治疗晚期实体瘤。根据公开信息显示,HG381是首个在中国自主研发获批开展临床研究的STING激动剂。

然而越来越多的研究发现,STING 信号通路的异常激活能诱发无菌性炎症疾病包括自身免疫疾病、神经退行性疾病、代谢紊乱疾病和癌症的发生和发展。因此,开发靶向 STING 蛋白的小分子抑制剂或激动剂,具有重要的基础研究意义和潜在的临床应用价值 。

在该研究中Biacore同样发挥了重要作用,证明小分子SN-011特异性结合STING蛋白,并且结合在STING蛋白与其内源性配体分子2’3’-cGAMP结合的口袋内,将 STING 二聚体锁定在开放、无活性的构象中,从而起到抑制STING信号通路的作用。
虚拟筛选及生物活性评估
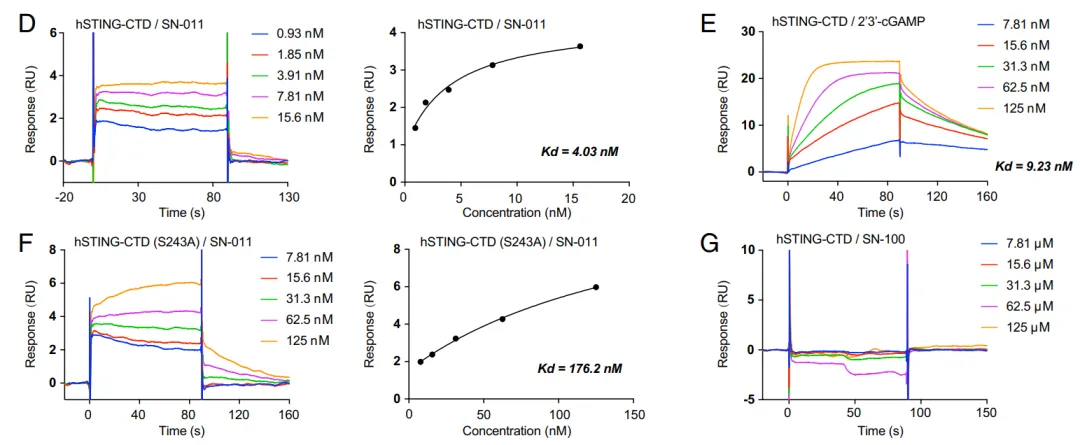
小分子结合活性表征与关键氨基酸验证
研究人员使用Biacore T200,将STING的C端功能域(CTD)固定在CM5芯片上,化合物SN-011作为流动相流经芯片表面,检测其亲和力KD。结果显示,化合物SN-011与STING蛋白的C端功能域(CTD)结合,并且亲和力为4.03 nM,高于天然配体2’3’-cGAMP与STING蛋白的亲和力(KD = 9.23 nM)。而阴性对照SN-100不与STING蛋白的C端功能域(CTD)结合。通过结构分析发现,STING 二聚体界面中的Ser243是SN-011的重要结合位点,将STING蛋白第243位的Ser突变为Ala后STING(S243A),化合物SN-011与STING(S243A)结合明显变弱(KD = 176 nM),表明S243是化合物SN-011结合的关键氨基酸位点。
疾病模型中功能验证
细胞毒性与特异性检测
通过RT-PCR、Western blots和Confocal,并对其生物活性进行评价,发现4个化合物(SN-001到SN-004)具有显著的抑制作用,其中SN-001是最具活性的化合物。使用Ni2+-NTA和Superdex 200进行STING蛋白纯化,进一步使用Biacore T200表征了SN-011与STING蛋白的结合亲和力。
通过结构分析发现,STING 二聚体界面中的Ser243是SN-011的重要结合位点,并通过Biacore T200得以证明。
通过检测小分子SN-011在STING相关疾病的细胞模型和动物模型中的作用,以及细胞毒性和特异性检测,证明SN-011可用于开发治疗 STING 驱动的自身免疫和炎症疾病的药物。

自 1990 年上市至今,Biacore作为唯一被中美日等多国药典收录的分子互作检测“金标准”,已广泛应用到基础科研与药物开发的多个领域。截至目前,借助 Biacore 累计发表的文章已突破 55,000 篇,超过 80% 的已上市的抗体药物的研发、申报、生产过程中也均有 Biacore 的身影。相信有了Biacore助力“产学研”,未来一定会有越来越多的中和抗体药物从研发走向上市。

 收藏
收藏 询价
询价