年度盘点:2021年借助Biacore在 FDA获批上市的抗体药
随着新年钟声的敲响,2022已经来临,过去一年美国食品药品管理局(FDA)的新药审评工作也已画上句号。回首过去的一年美国FDA共批准了50款新药上市。从历年的数据来看,这一数字在过去十年中排名第三,考虑到新冠疫情的影响,这个数量已经非常亮眼。从这些获批上市药物的分布种类看,FDA今年共批准9款抗体新药上市,累计批准上市的抗体新药达到108款。
作为同时被中、美、日药典收录的分子互作检测技术,Biacore 已经广泛应用到抗体药物筛选、活性检测、表位作图、一致性评价、免疫原性和质量控制等多个环节,以其卓越的性能和数据质量得到了药企和监管部门的广泛应用和认可。在去年FDA获批上市的9款抗体新药中,就有8款均采用了Biacore 技术完成研发和申报。下面小编就带大家详细盘点一下Biacore在这8款药物研发与申报中的应用。
新型降脂药EVKEEZA
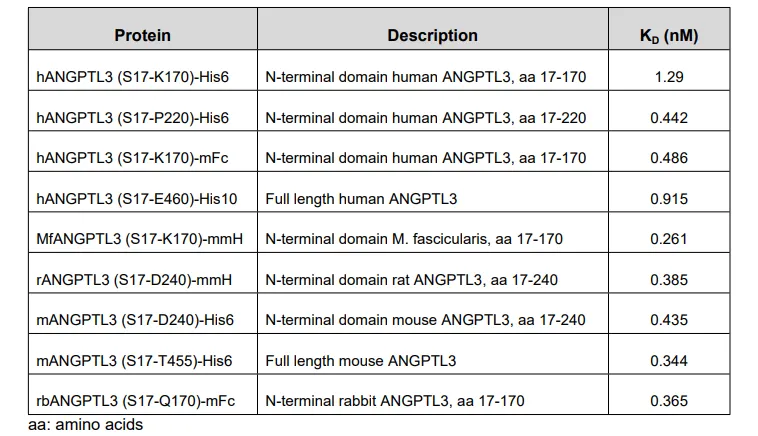
在这款新药的研发与申报中,Biacore被用于药物与靶点之间的亲和力检测。其申报材料中使用Biacore测定了Evinacumab与来自不同物种和其他ANGPTL家族成员的重组ANGPTL3蛋白的结合亲和力。结果表明 Evinacumab表现出与ANGPTL3蛋白N端结构域的高亲和力结合,该结构域中含有与人类,猴子,大鼠,小鼠和兔子的LPL结合的位点,并且KD值范围为0.3至1.3 nM(表1)。
此前,FDA授予了Evinacumab突破性药物资格(BTD),孤儿药资格和优先审评资格,此次批准是基于III期ELIPSE-HoFH研究(NCT03399786)的积极结果。Evinacumab由Regeneron开发,推荐剂量为15 mg/kg静脉输注,每4周1次。
首个子宫内膜癌抗PD-1疗法:JEMPERLI
在该药的研发与申报中,Biacore被用于评估多斯塔利单抗与纯化的人类和猕猴PD-1蛋白细胞外结构域的结合。dostarlimab与人类和猕猴PD-1的结合亲和力分别为0.3和0.5 nM,表明与PD-1蛋白的结合亲和力强。对于人类PD-1,多斯塔利单抗的结合速率为5.7×105(M-1s-1),解离速率为1.7×10-4(s-1),说明该抗体能够与靶标快速结合并保持非常强的稳定性(表2)。
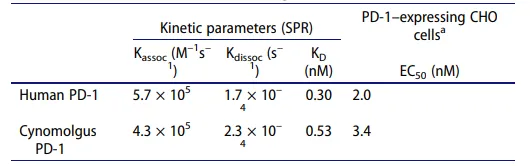
表 2. Biacore检测Dostarlimab与PD-1的亲和力和动力学数据
为了评估多斯塔利单抗Fc介导的功能,同样使用 Biacore测量了Dostarlimab与不同Fcγ受体的结合特性。作为对照的Adalimumab和MabThera都是IgG1抗体,能有效结合FcγRIIIa和FcγRI受体。但作为IgG4的Dostarlimab对FcγRIIIa的结合亲和力很低(图1),与FcγRI受体的亲和力也更弱(表3)。
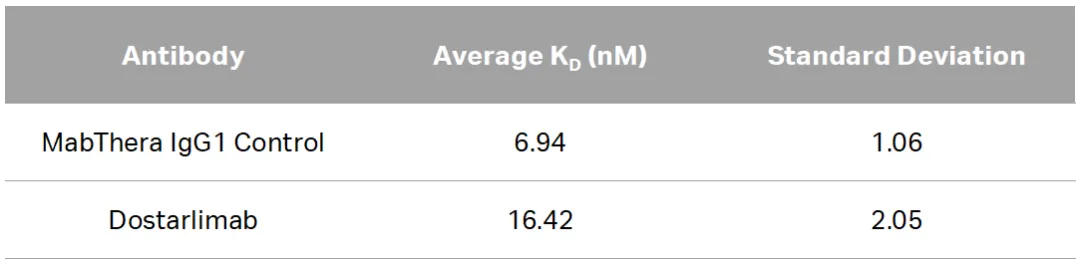
表 3. Dostarlimab与FcγRI(CD64)结合的SPR分析
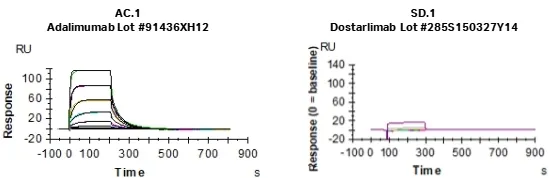
图1.基于SPR的Dostarlimab与FcγRIIIa(CD16a)的结合
值得一提的是,Dostarlimab是第一个被批准用于治疗子宫内膜癌的PD-1疗法,同时也是FDA批准的第七款PD-(L)1药物。此前,FDA授予了Dostarlimab突破性药物资格(BTD)和优先审评资格,此次批准是基于单组、多队列GARNET研究数据(NCT02715284)的积极结果。Dostarlimab的推荐剂量为第1-4剂用药500mg、每3周一次。从第4剂后3周开始的后续给药(从第5剂开始):1600mg、每6周一次。Dostarlimab通过静脉输液给药,输注时间大于30分钟。Dostarlimab由Tesaro开发,2018年GSK公司以51亿美元收购Tesaro获得。
首个阿尔茨海默病药物:ADUHELM
2021年6月7日, FDA首次批准了aducanumab-avwa(商品名ADUHELM),用于治疗阿尔茨海默症。aducanumab是一种靶向β淀粉样蛋白的单克隆抗体,β淀粉样蛋白斑块在大脑中的积累是阿尔茨海默症的一个重要病理特征。
在该药的研发与申报中,同样使用Biacore检测了chaducanumab及其类似物(chgantenerumab,3D6和m266)与不同状态的Aβ的结合选择性,并比较了它们与单体Aβ结合的亲和力和动力学。由于chaducanumab选择性地靶向聚集的Aβ,因此 表现出极弱的单体Aβ结合,而相比之下其类似物chgantenerumab,3D6和m266 Fab片段与Aβ之间显示出比chaducanumab-更强的亲和力(表4)。
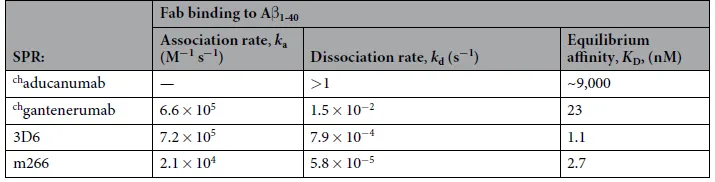
表 4. Biacore测定抗Aβ抗体Fab片段与Aβ1–40结合的亲和力和动力学
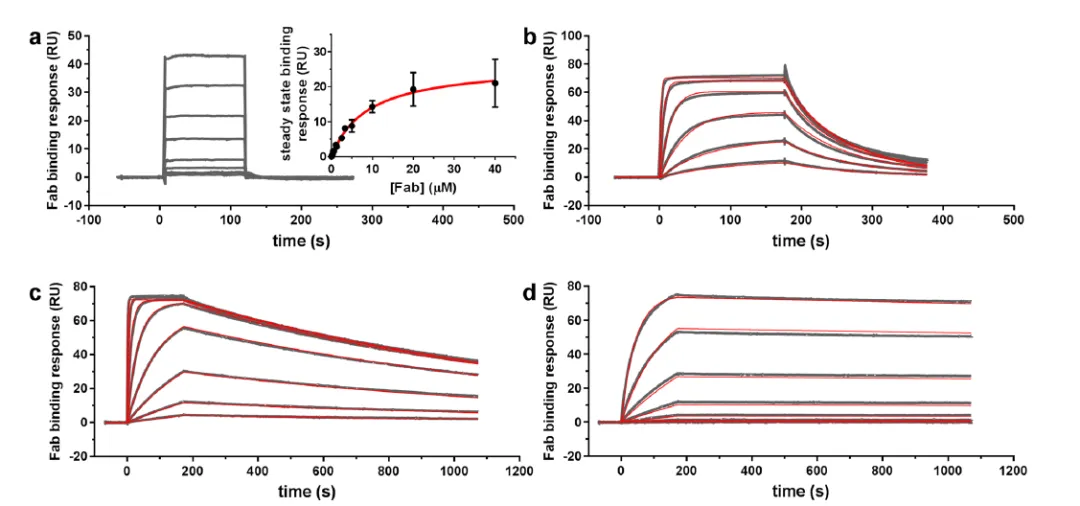
图2. 抗Aβ抗体Fab片段与固定在生物素捕获传感器芯片表面的Aβ1-40结合的传感图 (a) chaducanumab Fab (b) chgantenerumab Fab (c) 3D6 Fab (d) m266 Fab
aducanumab通过加速审批程序获得批准,是自2003年以来美国FDA批准的首个治疗AD的新药。此次批准是基于3项独立的临床试验结果,达到了大脑中淀粉样β斑块减少的替代终点,这些结果促进了Aduhelm的加速批准。aducanumab的推荐剂量为10mg/kg,每4周一次给药。
系统性红斑狼疮药物SAPHNELO
2021年7月30日, FDA首次批准了anifrolumab-fnia(商品名SAPHNELO),用于正在接受标准疗法的中度至重度系统性红斑狼疮(SLE)成人患者的治疗。anifrolumab是一种靶向 I型IFN受体的亚基1的全人源单克隆抗体,可阻断I型IFN的活性。I型IFN如IFN-α、IFN-β和IFN-κ是参与调节SLE炎症通路的细胞因子。此次批准,基于两项名为TULIP的3期临床试验(NCT02446912和NCT02446899)以及名为MUSE的2期临床试验(NCT01438489)的疗效和安全性数据。anifrolumab推荐剂量为每4周300mg静脉滴注。
Anifrolumab的重链Fc恒定区域含有三个氨基酸突变(L234F/L235E/P331S),以减少与FcγRs的结合并最大限度地减少抗体介导的效应器功能。与原初抗体相比,这些Fc修饰有效降低了anifrolumab与FcγRs的结合。随后他们同样借助Biacore T200分别检测了重组FcγR1,FcγR2a,FcγR2b和FcγR3a-158F与anifrolumab的结合。通过氨基偶联方式将Parental Ab与anifrolumab固定在CM4传感芯片上。每个FcγR以及阴性对照卵清蛋白使用HBS-EP缓冲液稀释到1mM进行比较评估。结果表明,Parental Ab能结合所有测试的FcγR蛋白。与Parental Ab相比,anifrolumab与这些FcγR蛋白的结合明显减弱。
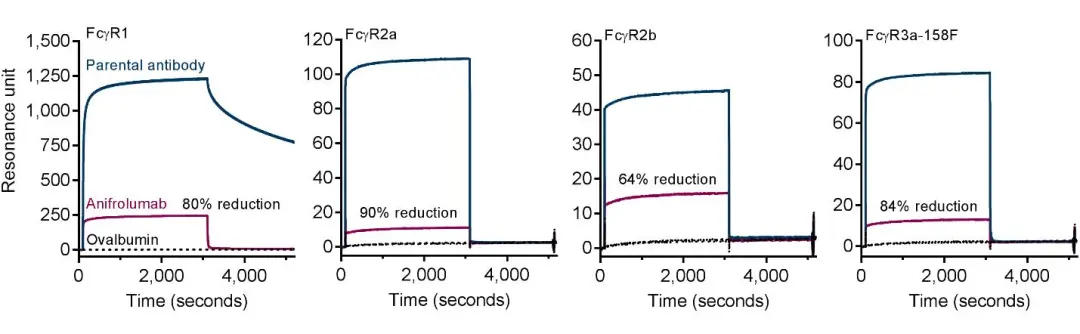
图3. anifrolumab与Fcγ受体蛋白的结合
anifrolumab由阿斯利康于2004年通过与Medarex公司的独占许可(exclusive license)和合作协议获得了全球权利。anifrolumab用于治疗SLE的许可也正在欧盟和日本接受监管审评。在国内,阿斯利康按治疗用生物制品1类递交的Saphnelo注射液临床试验申请获得默示许可,拟开发用于中度至重度活动性系统性红斑狼疮的治疗。
首个靶向组织因子抗体偶联药物TIVDAK
2021年9月20日, FDA首次批准了Tisotumab vedotin-tftv(商品名TIVDAK)用于在化疗期间或化疗后病情进展的复发性或转移性宫颈癌患者。Tisotumab vedotin是一种靶向组织因子(tissue factor,TF)的抗体药物偶联物(ADC),TF在宫颈癌细胞上表达,可促进肿瘤生长、血管生成和转移。此次批准,基于关键II期innovaTV 204研究的疗效和安全性数据。Tisotumab vedotin由西雅图遗传学公司和Genmab公司联合开发,结合了Genmab公司的TF靶向单抗Tisotumab以及西雅图遗传学公司的ADC技术。Tisotumab vedotin推荐剂量为每3周2mg/kg静脉滴注。
TF-TCB是一种四价双特异性抗体,具有两个CD3和两个TF结合位点。在这款药物的研发与申报中,他们同样利用Biacore测定了TF-TCB与CD3D CD3E异源二聚体和TF抗原的结合亲和力分别为14.9和0.839 nM,与临床试验中的其他TCBS相当。
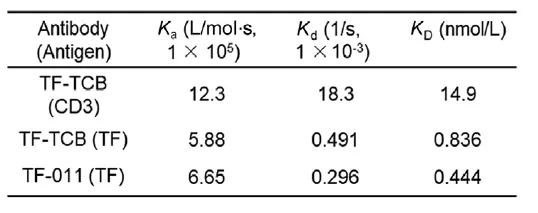
表5.TF-TCB和TF-011的结合动力学和亲和力
哮喘重磅新药:Tezspire
2021年12月17日, FDA首次批准了Tezepelumab-ekko(商品名Tezspire),作为一种附加维持疗法,用于治疗年龄≥12岁的严重哮喘儿科患者和成人患者。Tezepelumab是一种靶向胸腺间质淋巴细胞生成素(TSLP)的单克隆抗体,TSLP是一种上皮细胞因子,在哮喘炎症中起关键作用。此次批准,基于关键性III期NAVIGATOR试验的疗效和安全性数据。Tezepelumab推荐剂量为每4周210mg皮下注射。
AMG 157 (tezepelumab)是一种全人源抗TSLP单克隆IgG2λ,特异性结合人TSLP并抑制其与受体的相互作用。在这款药物的研发与申报中,通过Biacore进行亲和力检测和竞争性研究,以确定AMG 157( tezepelumab)的TSLP结合特性,并证明其阻断TSLP与TSLPR相互作用的能力。AMG 157以高亲和力(pM范围)结合人类和猕猴TSLP(表6),并抑制人和猕猴TSLP蛋白与TSLPR相互作用。
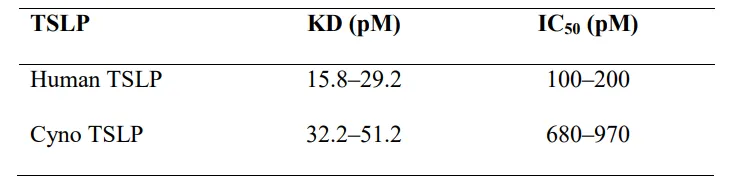
表 6.AMG 157 效力和结合亲和力特性
在2018年9月,美国FDA授予了tezepelumab治疗无嗜酸性粒细胞表型严重哮喘的突破性药物资格(BTD)。值得一提的是,在治疗严重哮喘方面,Tezspire是唯一一个没有表型(如嗜酸性粒细胞或过敏)或生物标志物限制的生物制剂。Tezepelumab由安进和阿斯利康公司联合开发。
重症肌无力新疗法vyvgart
2021年12月17日,FDA批准了 Vyvgart(efgartigimod)用于治疗抗乙酰胆碱受体(AChR)抗体检测呈阳性的成人全身性重症肌无力(gMG)。 该药是首个获批的针对这种罕见的慢性自身免疫性神经肌肉疾病治疗的新型药物,它是一种与新生儿 Fc 受体 (FcRn) 结合的抗体片段,可防止 FcRn 将免疫球蛋白 G (IgG) 再循环回血液。该药物会导致 IgG 的整体水平降低,包括重症肌无力中存在的异常 AChR 抗体。
Vyvgart 由Argenx研发,在其Fc区域引入了5个位点突变:M252Y、S254T、T256E、H433K、N434F。这些突变确保其在酸性和碱性条件下与FcRn的亲和力均增强,pH=6.0条件下的亲和力为14.2nM,pH=7.4条件下的亲和力为320nM,Efgartigimod在pH 7.3-7.4下的亲和力比pH 6.0时低约20倍。这种pH依赖性使得高比例的抑制剂在表达FcRn的细胞中得以回收。并且使用剂量相较于传统IVIg(静脉注射免疫球蛋白), Efgartigimod有大约30倍的降低。
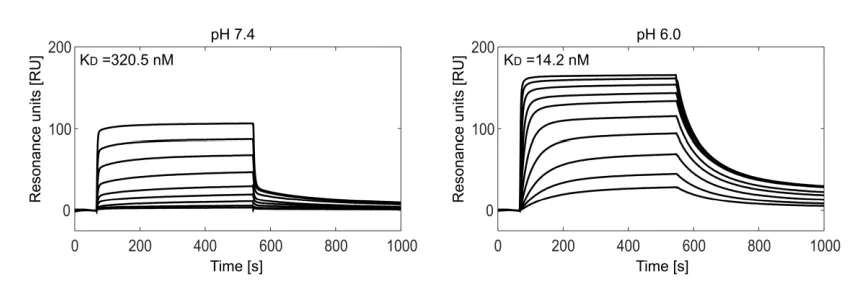
图4. 使用SPR检测Efgartigimod与人FcRn的结合
首款IL-13抑制剂Adbry
2021年12月27日,FDA又批准了IL-13抑制剂Adbry(tralokinumab)用于治疗18岁或以上、疾病无法通过局部处方疗法充分控制或治疗的中重度特应性皮炎患者。Adbry是一款能够与IL-13高亲和力结合的全人源化单克隆抗体。它不但能够阻断IL-13与IL-13Rα1的结合,还能够阻断IL-13与IL-13Rα2的结合。
Tralokinumab是一种噬菌体展示衍生的抗体,在该抗体的研发过程中,也同样离不开Biacore。Biacore 检测结果表明该抗体能够特异性结合IL-13,并且两者间的亲和力高达58 pM(表7)。后续研究表明该抗体通过抑制IL-13与IL-13Rα1,IL-4Rα和/或IL-13Rα2的结合而发挥作用。随后结合该抗体与IL-13复合物的晶体结构,研究人员又鉴定了两者间结合的关键氨基酸,并且Biacore检测结果显示这些氨基酸位点的突变能够大大降低该抗体与IL-13结合的亲和力。
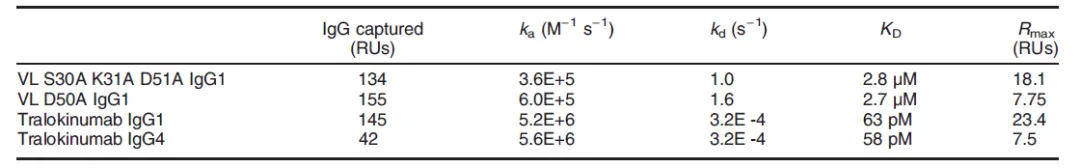
表7. Tralokinumab及其相应结合位点的氨基酸突变与IL-13结合的亲和力变化
纵观 2021年FDA批准的所有抗体新药,虽然在数量上并不多,但新型抗体药物形式却越来越多,双抗、ADC、Fc突变体等不一而足,充分凸显了抗体药物研发的深化。另外,抗体药物的筛选技术也越来越多样化,除了传统的人源化、转基因动物来源的之外,人B细胞测序(Aducanumab)、动物细胞展示等技术来源的抗体也进入了商业化阶段。并且新靶点抗体药的占比越来越多,除了PD-1抗体Dostarlimab外,其他抗体新药几乎全都是FIC。但无论是何种形式的抗体,也不管是那种来源,这些获批上市的抗体药物几乎全部都不约而同地选择了Biacore进行研发与申报,充分说明了Biacore绝对是抗体药物研发与申报中的必备工具。目前,以Biacore 为代表的表面等离子共振技术已经被中国、美国和日本药典收录,其卓越的性能和数据质量已经得到了药企和监管机构的广泛应用和认可,从而助力越来越多的抗体药物从研发走向上市。

 收藏
收藏 询价
询价