别构激酶抑制剂的避孕分子机制新发现
2023年6月3日,美国明尼苏达大学Gunda I. Georg教授在Nature communication上发表题为“Development of allosteric and selective CDK2 inhibitors for contraception with negative cooperativity to cyclin binding”的研究论文。CDK2(细胞周期蛋白依赖性激酶2)是许多治疗适应症的靶点,包括非激素避孕。研究团队发现了一类高亲和力结合CDK2的邻氨基苯甲酸衍生物抑制剂,这类抑制剂的优势在于:
- 比起先前的ATP位点抑制剂具有更好的选择性;
- 更小的脱靶毒性;
- 更好的亲和力及更慢的脱靶速率。
探索改进物理化学性质的新型抑制剂
新型别构抑制剂可以破坏在精母细胞减数分裂至关重要的CDK2/SPY1蛋白互作,并且保留了CDK2与细胞周期蛋白结合的活力,从而提供了一种安全有效的避孕选择。
为了探讨别构抑制剂5的选择性,研究人员引入了ATP位点CDK2抑制剂dinaciclib这款药物作为对比。如图1所示,dinaciclib不仅可以结合到靶点CDK2的上,还可以与CDK1结合,从而表现出脱靶毒性。而通过Biacore实验,可以简单地验证出别构抑制剂5对靶点CDK2的选择性,如图2及图3所示,抑制剂5仅与靶点结合,而不与CDK1结合。
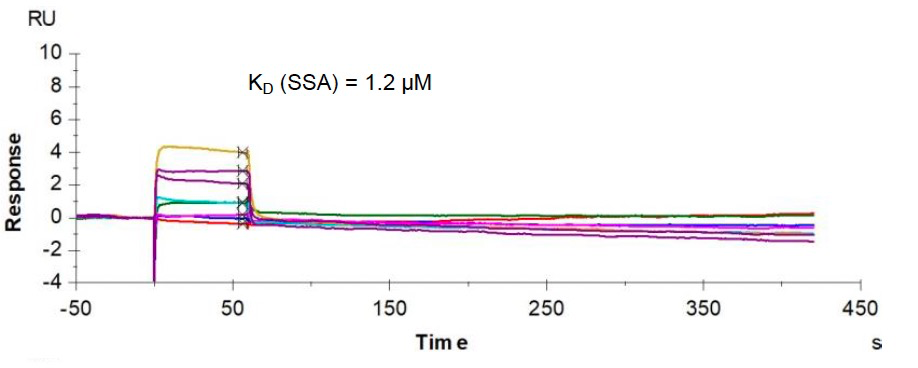
图1:ATP抑制剂dinaciclib与CDK1结合
注:SSA为作者简写的Biacore分析方法Steady-state affinity
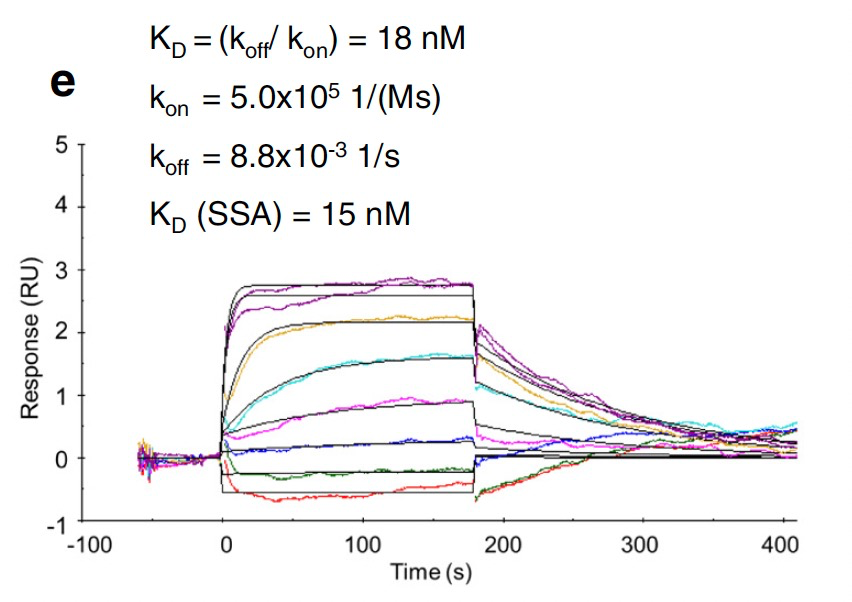
图2:抑制剂5以nM亲和力结合CDK2
注:SSA为作者简写的Biacore分析方法Steady-state affinity
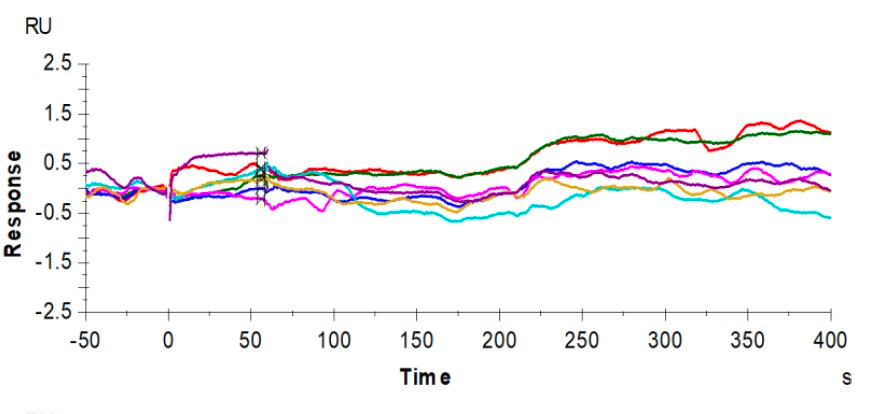
图3:抑制剂5不结合CDK1
值得注意的是,研究人员发现,这些别构抑制剂与细胞周期蛋白结合表现出强烈的负协同关系,那么其具体机制是怎样的呢?
研究人员通过Biacore实验发现:别构抑制剂结合靶点是典型的“快上快下”模式,而细胞周期蛋白与靶点的结合,是典型的动力学曲线,具有较慢的解离速率(如图4所示)。正如图5的构象图所示,当细胞周期蛋白与CDK2结合时,其缓慢的解离使CDK2无法获得别构抑制剂结合所必需的非活性构象,相反,别构抑制剂的快速解离允许细胞周期蛋白结合CDK2,并将其困在活性的构象中。这也就解释了两者之间的非竞争结合CDK2,但是却呈现出负协同关系。Biacore不仅能给到亲和力数据,还能给出分子间结合实时的动力学,动力学数值可以表征分子结合/复合物稳定性的重要信息。
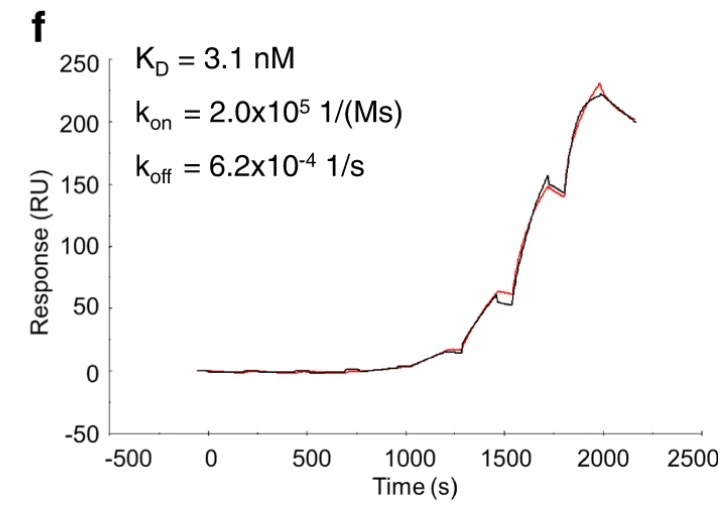
图4:细胞周期蛋白与CDK2结合
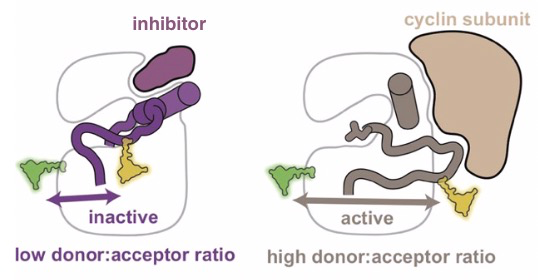
图5:CDK2与抑制剂结合的非活性构象及与细胞周期蛋白与结合的活性构象
小结:最后,研究人员使用这些化合物开展了一系列生物学测试,结果验证了之前的研究,并发现这类别构抑制剂有望进一步发展成为靶向CDK2的选择性疗法,并且验证了它们具有作为避孕药的潜力。
Biacore已成为在科研及药物研发中不可或缺的利器,在这篇文献里,科研人员不仅对药物的选择性做了深入的研究,并且从分子机制解释了“为何这类药物与细胞周期蛋白结合表现出强烈的负协同关系”,验证了其结构学的结论。在药物研发领域上,不论是抗体、疫苗、小分子,或者是本文所研发的蛋白激酶抑制剂,Biacore都一直陪伴着我们广大的科研及药物研发人员,可谓是“Biacore在侧,药物研发不会愁”。
Faber, Erik B et al. “Development of allosteric and selective CDK2 inhibitors for contraception with negative cooperativity to cyclin binding.” Nature communications vol. 14,1 3213. 3 Jun. 2023, doi:10.1038/s41467-023-38732-x

 收藏
收藏 询价
询价