PROTAC赛道卡脖子问题如何突破?
PROTAC(蛋白降解靶向嵌合体)概念早在2001年就出现了,实际上,直到2015年Pomalidomide为E3泛素连接酶配体的dBET1 PROTAC成功降解BET蛋白,PROTAC领域才进入快速发展期。究其原因,E3泛素连接酶配体的稀缺成为制约PROTAC发展的卡脖子问题。
近日,PROTAC明星公司Arvinas使用Cytiva Biacore分子互作仪发现了全新的E3泛素连接酶配体,成功“扩容”E3泛素连接酶库。这其中Biacore在不同层面上的应用大大拓展了PROTAC领域的玩法,接下来我们就一睹为快。

图1:文章标题截图
01. 联合CADD等技术,检测小分子结合活性与关键结合位点
研究人员使用计算机辅助药物设计并合成模拟小分子,利用Biacore平台,以KLHDC2 (E3 ligase) 为配体,检测模拟分子KDRLKZ的结合活性与关键结合位点。
图2:合成分子结构示意图
Biacore结果显示,KDRLKZ-1与KLHDC2具有较好的结合活性,KD为0.36 μM(图3)。如果用酰胺取代KDRLKZ的酸基,二者的结合将会发生明显变化(图4)。
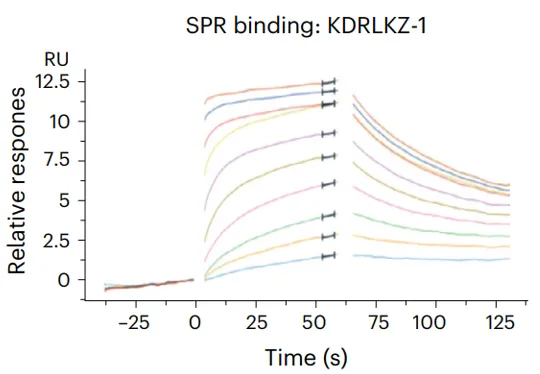
图3:KDRLKZ-1与KLHDC2结合动力学数据
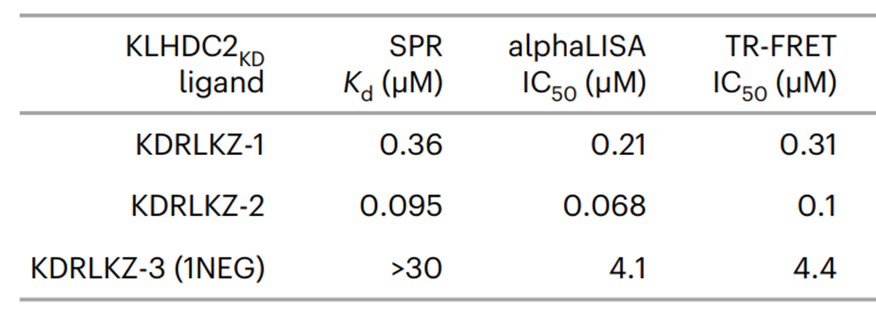
图4:KLHDC2与KDRLKZ变体结合数据
02. Biacore验证PROTAC分子具备诱导靠近效应能力
研究人员合成一系列KLHDC2–BRD4 PROTAC分子,以BRD4为配体,以有无预混KLHDC2的KLHDC2–BRD4 PROTAC为分析物,进行Binary SPR assay、Ternary SPR assay。实验数据显示,K2-B4-3表现出强烈的三元络合物形成效果,并且形成效率依赖于KLHDC2的募集。
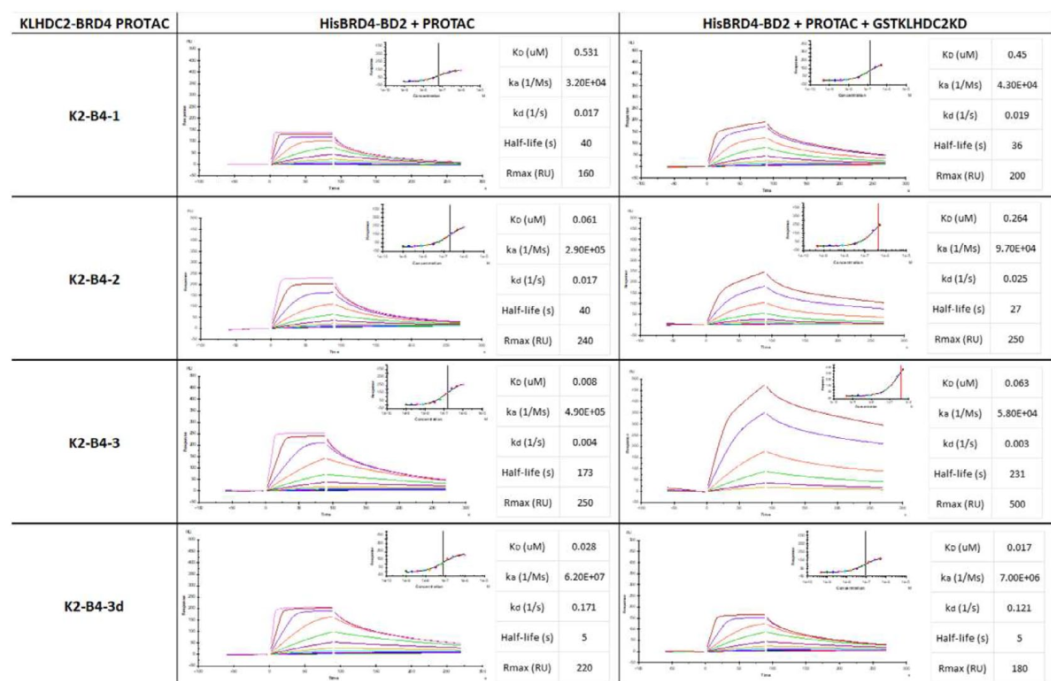
图5:Binary SPR assay、Ternary SPR assay
03. Biacore验证PROTAC分子诱导靠近效应的影响因素
为了更好地了解PROTAC分子诱导靠近效应的机制,研究人员针对于Linker长度与组成进行了探索,实验设计与Binary SPR assay、Ternary SPR assay相同。Biacore结果显示,三元复合物的形成同样取决于Linker的长度和组成:一个更长的,结构化的Linker是非常关键的(图6)。
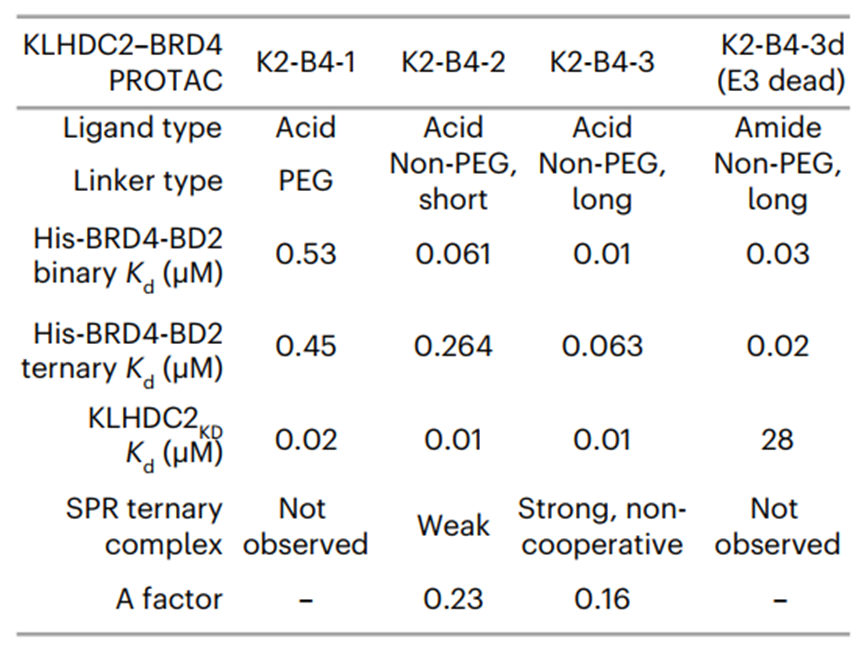
图6:Ternary complex SPR experiments
总结:
总览全文,研究人员有三处Biacore的运用让人印象深刻:
- 纵向联合应用。与CADD、分子合成等技术形成上下游的纵向联合,将分子模拟,从头合成,结构优化,活性验证,关键结合位点分析等环节紧密串联,形成一整套结构化、流程化的完整方案。
- 横向相互验证。与alpha LISA、TR-FRET等技术形成横向联合,针对于结合活性开展同步实验。最终结果显示,三者的数据高度统一、相互辅证。
- Biacore数据KD与Rmax的双向应用。Binary SPR assay、Ternary SPR assay中KD的数据直观、精准地向我们展示了各个分子之间的结合能力,同时,Rmax的数据向我们展示出三元络合物形成效率,进而展示PROTAC诱导靠近效应的能力。这种创新性的应用,值得我们借鉴。
参考文献:
Hickey, C.M., Digianantonio, K.M., Zimmermann, K. et al. Co-opting the E3 ligase KLHDC2 for targeted protein degradation by small molecules. Nat Struct Mol Biol (2024). https://doi.org/10.1038/s41594-023-01146-w

 收藏
收藏 询价
询价