分子动力学模拟+Biacore携手揭开药物设计新纪元!
图1:生物实验设计逻辑
在实验层面,分子相互作用的研究早已脱离了只看亲和力的时代,需要Biacore这样的互作设备同时获得亲和力和动力学数据。而在计算生物学的模拟研究中,分子对接 (Molecular docking) 也逐步走向历史,最接近实验条件的模拟方法——分子动力学 (Molecular Dynamics,MD) 模拟更受青睐,它能够从原子层面给出体系的微观演变过程,直观的展示实验现象发生的机理与规律。但最好的模拟也要落到实验层面进行验证,所以分子动力学 (MD) 模拟+Biacore的黄金搭档,可以携手揭开药物理性设计的新纪元!
“黄金拍档”在CAR-T细胞治疗研究中大显身手
由于靶向CD19的CAR-T细胞治疗已经成功治疗了难治性/复发性B细胞恶性肿瘤,所以CD19 CAR – T细胞疗法已成为癌症免疫治疗的典范。早期CAR-T设计中,认为高亲和力的“粘合剂”(即scFv)可以更好地结合靶标CD19,就可以具有更好的CAR性能,但后续临床以及Biacore实验发现亲和力并不是越高越好。(☞ 号外!号外!Biacore爆出CAR-T设计惊天大秘密!)但具体的亲和力调节机制、调节位点、如何更有效地获得更优分子仍然未知。
从结构和功能角度解析CD19-CAR抗原亲和调控机制
2023年3月,来自美国康奈尔大学Joel R. Meyerson团队和MSKCC中心的Michel Sadelain团队联合在国际顶级期刊Science Immunology (IF:30.658) 发表了题为“CD19 CAR antigen engagement mechanisms and affinity tuning”的最新研究(第一作者为Changhao He博士),通过分子动力学 (MD) 模拟+Biacore验证的方式,从结构和功能角度解析了CD19-CAR抗原亲和调控机制(图2),并为后续CAR分子设计,提供了一个广泛适用的CAR-T设计优化模板。
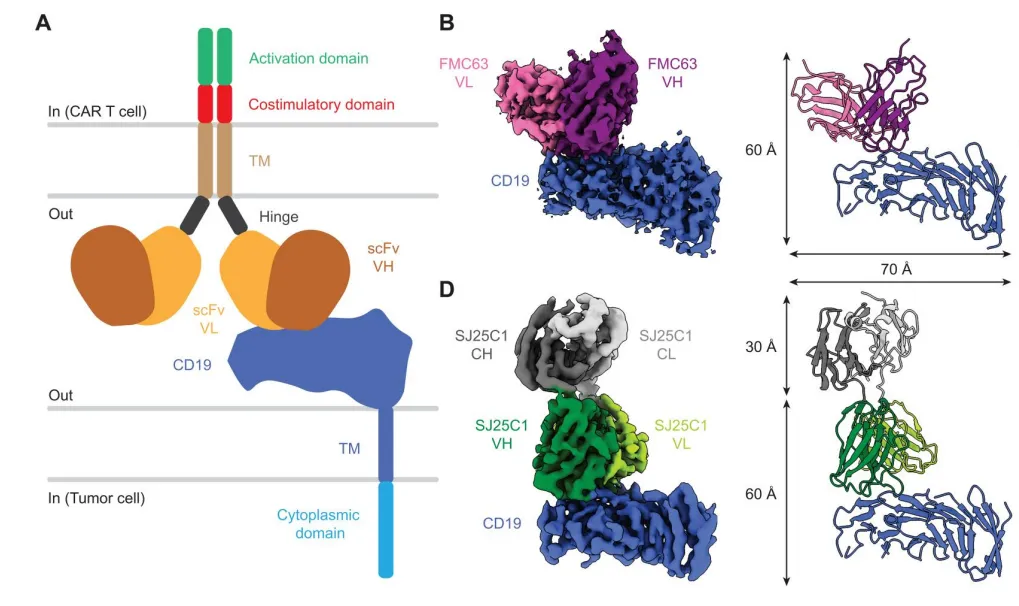
图2:CAR-T细胞上的CAR与CD19的复合物结构
在这项研究中,作者研究了靶向CD19的两种不同CAR结合物的抗原结合机制,包括用于四种美国FDA批准的CAR设计 (Kymriah、Yescarta、Tecartus、Breyanzi) 的“粘合剂”(即svFc)FMC63,以及最初在纪念斯隆凯特琳癌症中心 (MSKCC) 进行CD19 CAR临床试验中使用的“粘合剂”SJ25C1。作者首先用冷冻电子显微镜 (cryo-EM) 解析了两种结合物与CD19的复合物结构并确认了共同结合的CD19关键表位( Arg163, Lys220和Pro222)。随后,作者开始研究CAR设计的亲和力调节机制。作者使用前期的结构研究进行了分子动力学 (MD) 模拟,逐一对两种“粘合剂”的残基与CD19结合的贡献度进行排序,确定了介导CAR结合的主要残基,FMC63中排名最高的残基是Y70、Y260和Y261,在SJ25C1中,是 I120、V123和V124。(图3)
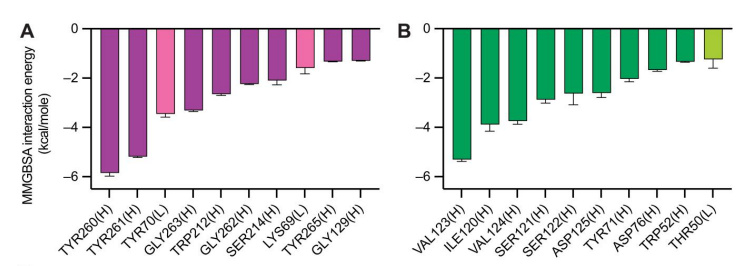
图3:MD模拟确定两种scFv的关键结合位点 (A:FMC63;B:SJ25C1)
为了验证上述位点的关键性能以及同时获得更低亲和力的突变体,针对FMC63上述位点,作者使用丙氨酸进行点突变获得残基更短的突变体FMC63_Y260A, FMC63_Y261A, FMC63_Y70A;针对SJ25C1,作者使用甘氨酸、缬氨酸等对几个关键结构位点进行突变,获得突变体SJ25C1_V123G, SJ25C1_I120G, SJ25C1_V124G, SJ25C1_I120V, SJ25C1_I120A, SJ25C1_S121A, SJ25C1_W52F。随后使用Biacore 8K对突变体与CD19的亲和力进行检测,由于突变体以含his标签的Fab形式进行表达,配合Biacore对应的NTA芯片与NTA试剂盒,可以重复利用芯片,捕获不同突变体,随后使用单循环动力学的方式进样不同浓度的CD19蛋白,进行亲和力动力学检测(图4)。单循环动力学 (SCK kinetics) 是Biacore特有的动力学检测方案,该实验可以在无需再生的情况下进行多浓度进样实验,可以在更短时间内完成大量的互作实验需求,节省人力物力成本。
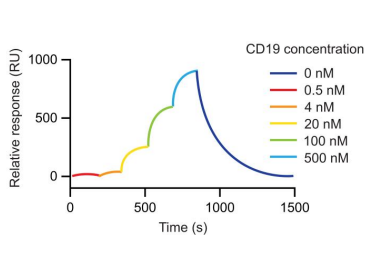
图4:不同突变体与CD19的SCK实验设计方案
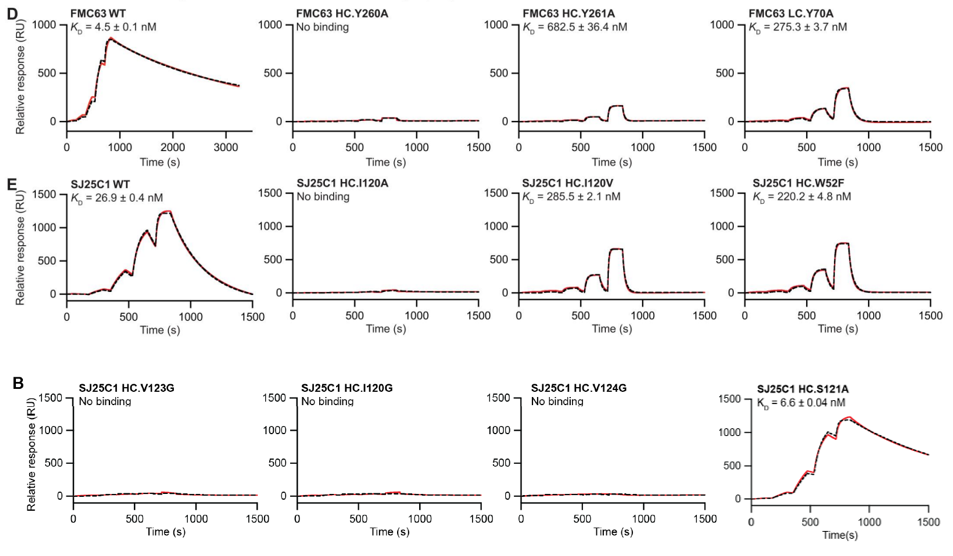
图5:不同突变体与CD19的亲和力/动力学
结果如图5所示,对于未修饰的FMC63 WT与SJ25C1 WT与CD19,呈现和文献记载相同的较好的亲和力 (KD=4.5 nM/26.9 nM) ,由于Biacore不仅可以检测亲和力,同时可以获得动力学数据,所以可以看到FMC63 WT具有更慢的解离速率。更慢的解离速率更有利于CAR-T细胞持续发挥作用,这可能也是四款CAR-T获批药物均使用该scFv的原因之一。
- 对于FMC63的突变体,FMC63_Y260A无法检测到其与CD19的亲和力, FMC63_Y70A , FMC63_Y261A亲和力有了明显削弱 (KD=275.3 nM / 682.5 nM) ,验证了针对FMC63, 分子动力学 (MD) 模拟筛选的关键位点是完全正确的。
- 对于SJ25C1突变体,SJ25C1_V123G, SJ25C1_I120G, SJ25C1_I120A, SJ25C1_V124G均无法检测其亲和力,SJ25C1_I120V, SJ25C1_W52F亲和力明显降低 (KD=285.5 nM / 220.2 nM) , 与MD模拟结果一致。
其中SJ25C1_S121A出现了亲和力增加 (KD=6.6 nM) ,作者推测是由于丙氨酸导致了变构效应,其蛋白骨架而不是该残基发生了作用。所以总得来说,MD模拟对于结合贡献度的推测,在Biacore的验证下均证明了是一致的。这也证明了MD模拟+Biacore验证的方法在关键位点探寻的过程中可以起到至关重要的作用。
后续进一步针对含有上述突变体的CAR-T细胞进行研究,从细胞实验层面可以明显看出,在保持结合能力的突变体中,亲和力更低的突变体FMC63_Y261A (KD=682.5 nM) ,可以在保持有效结合,保持细胞裂解能力的同时控制胞浆增生,避免其带来的自损伤,是更优的CAR分子设计。到这里本文作者也根据对于CAR分子与CD19抗原的结构与功能分析,确定了一套针对CAR分子的进一步优化的设计策略,可以避免再去大量盲筛scFv,只需要根据MD模拟和Biacore验证所确定的几个关键位点,从而去设计获得亲和力低,效果好的CAR分子,这样的理性设计方案,终究是更有意义的CAR-T细胞设计方案!
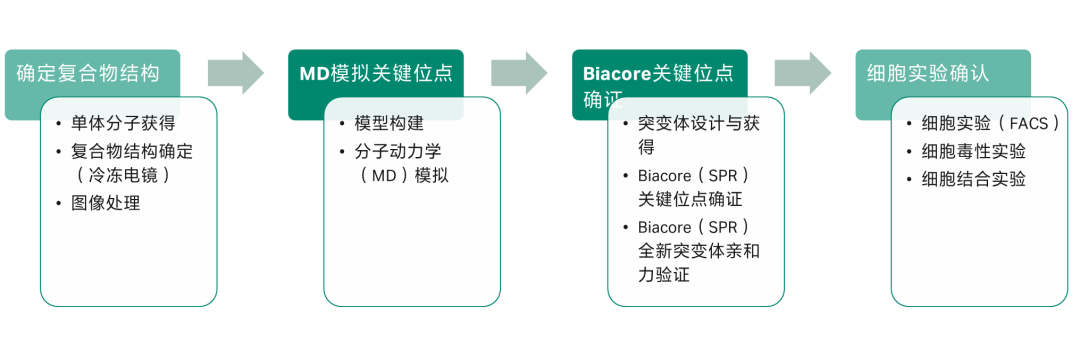
图6:针对CAR分子的进一步优化的设计策略
在多个领域助力研究的“黄金拍档”MD模拟+Biacore
分子动力学 (MD) 模拟+Biacore作为药物理性设计的黄金拍档,不仅仅可以在CAR-T研究中大显身手,在靶点确证、信号通路研究、药物筛选、药物载体设计等等领域均可发挥作用。国内近年来也有很多老师已经开始使用该方法,例如:
- 北京大学的谢英教授团队,使用MD模拟+Biacore完成了对纳米颗粒载药系统的研究。
- 重庆理工大学林治华教授团队也使用MD模拟+Biacore完成了对PD-1多肽药物的筛选等等。
只要基于结构信息,均能进行MD模拟,模拟结果无论对象是小分子、蛋白、多肽、抗体或其他分子,由于Biacore对分子量检测无限制,均能配合完成高效检测!同时Biacore 8K/8K+可以容纳4-12块96/384孔板,支持更大数据库量级的位点验证实验。即使后期计算生物学与人工智能对接,Biacore 8K/8K+与人工智能配合同样有高超表现(☞ 抗体药物研发新模式:AI + Biacore),仍能高通量完成数据验证,推动优化药物设计!
小 结
1. Changhao He et al. ,CD19 CAR antigen engagement mechanisms and affinity tuning.Sci. Immunol.8, eadf1426(2023).DOI:10.1126/sciimmunol.adf1426
2. Lin SH, Cui W, Wang GL, et al. Combined computational and experimental studies of molecular interactions of albuterol sulfate with bovine serum albumin for pulmonary drug nanoparticles. Drug Des Devel Ther. 2016;10:2973-2987. Published 2016 Sep 15. doi:10.2147/DDDT.S114663
3. Wang Y, Guo H, Feng Z, et al. PD-1-Targeted Discovery of Peptide Inhibitors by Virtual Screening, Molecular Dynamics Simulation, and Surface Plasmon Resonance. Molecules. 2019;24(20):3784. Published 2019 Oct 21. doi:10.3390/molecules24203784

 收藏
收藏 询价
询价