再发Nature Plants封面文章 —— Biacore助力发现水稻抗击病菌入侵的“秘密武器”
探索水稻抗病性是研发环境友好型病害防控技术的基础,对稳定全球粮食供应起着重要作用。已有证据表明,抗病性进化主要由植物先天免疫系统与病原菌的“战备竞赛”所驱动。最近有研究报道,植物微生物群落和植物生长环境可能共同调控着宿主植物的抗病性,但是相关机制目前仍鲜有报道。

图1 《Nature Plants》封面论文
近期,植物科学顶级期刊《Nature Plants》以封面论文形式刊登了浙江大学农业与生物技术学院王蒙岑研究组题为Bacterial seed endophyte shapes disease resistance in rice的研究成果。该研究发现,在水稻细菌性穗枯病菌Bp侵染时,瓜类鞘氨醇单胞菌(Sphingomonas melonis)会释放小分子氨茴酸(Anthranilic Acid,简称AA,分子量137 Da)。
通过Biacore技术检测发现,氨茴酸直接与水稻细菌性穗枯病菌Bp的sigma因子RpoS(分子量~ 55 KD)相互作用(RpoS是毒素托酚酮TR生物合成通路的上游因子),从而抑制水稻细菌性穗枯病菌Bp合成毒素托酚酮TR,避免了水稻幼苗枯萎病和谷物腐烂的发生。该研究率先揭示了水稻与种子内生菌响应病原菌胁迫的共进化规律,并提出种子是亲本抗病性进化遗产的新观点。研究为抗病性资源挖掘、抗病性丧失治理开辟了新途径,对研发新型微生物组绿色农药具有重要意义。
在这篇文章中研究人员首先在筛选水稻抗病性表型时,发现了一种有趣的表型分化现象。抗病性分化表型具有地理分布特异性,且与其种子内生细菌群落结构的差异紧密相关。其中鞘氨醇单胞菌属(Sphingomonas)在抗性表型中显著富集。进一步研究发现,核心成员瓜类鞘氨醇单胞菌(Sphingomonas melonis)不仅能在抗性表型中世代传递,而且可赋予易感表型抗病性。当细菌性穗枯病菌Bp侵染水稻时,瓜类鞘氨醇单胞菌分泌胞外信号小分子氨茴酸AA,在水稻质外体中积累。并且,水稻细菌性穗枯病菌Bp产生的毒素托酚酮TR显著降低。
前人的研究表明,水稻细菌性穗枯病菌Bp通过产生的毒素托酚酮TR,造成水稻幼苗枯萎病和谷物腐烂。并且,RpoS作为托酚酮TR的生物合成的上游调控因子,对其生物合成十分关键。那么瓜类鞘氨醇单胞菌分泌的氨茴酸AA能否抑制毒素托酚酮TR的生物合成?是否通过直接与RpoS相互作用,从而抑制托酚酮TR的生物合成呢?
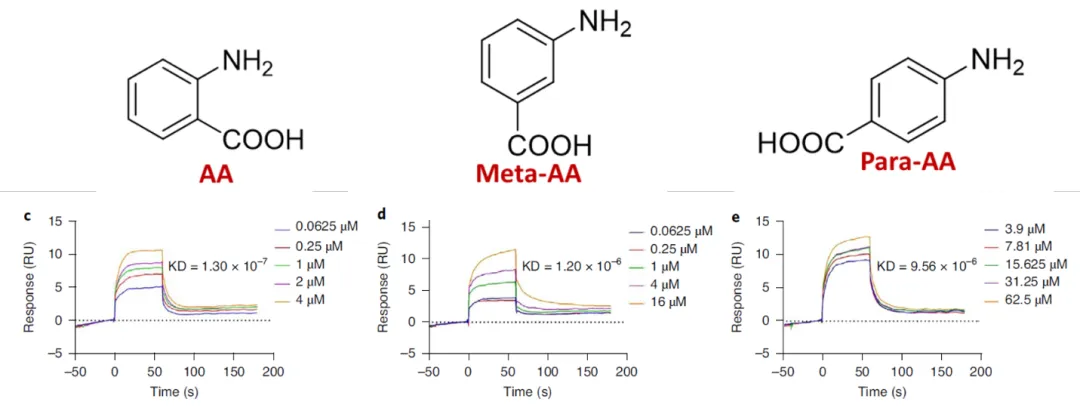
图2 Biacore实验证明RpoS与AA直接结合
研究人员使用Biacore T200,将RpoS固定在CM7芯片上,氨茴酸AA作为流动相流经芯片表面,检测其亲和力KD。结果显示,氨茴酸AA与RpoS能够结合,并且亲和力为0.13 μM。进一步,研究人员比较了氨茴酸AA同系物(Meta-AA和Para-AA)与RpoS的亲和力,结果显示两个同系物与RpoS的亲和力分别为1.20 μM和9.56 μM,比氨茴酸AA与RpoS的亲和力低了1-2个数量级。该亲和力结果与功能实验结果呈正比例相关。至此,科研人员发现瓜类鞘氨醇单胞菌分泌的氨茴酸AA可以通过直接与RpoS结合,抑制水稻细菌性穗枯病菌Bp中毒素托酚酮TR的生物合成,从而赋予水稻对该病原体的抗性。
该研究中,对于蛋白RpoS与小分子AA的相互作用检测,有两大难点:
- 小分子AA的分子量较低(<150 Da),结合产生的信号很弱,往往只有10 RU(RMS)左右,这已经到达了其他检测技术的灵敏度极限,因此同类的检测方法往往束手无策。而Biacore T200对于小分子的检测无分子量下限,具有高达pg级别的超高灵敏度0.03 RU(RMS),甩开同类技术2个数量级以上,能够确保了低信号的结合也能精确检测。
- 小分子AA的水溶性较差,需要DMSO等有机溶剂助溶,然而,DMSO这类有机溶剂会造成任何光学互作检测系统的检测误差,需要将该误差扣除,才能得到更加真实可靠的数据。Biacore直面挑战,开发出溶剂矫正功能,可完美消除DMSO等有机溶剂造成的误差,得到更加真实可靠的数据。
作为分子互作金标准,Biacore可检测样品的范围十分宽泛,除了分子量较大的蛋白、多肽、抗原、抗体、核酸、多糖等,还能检测离子、小分子化合物等分子量较小的分子也同样能够检测,并给出漂亮的数据。这篇文章也再次证明,对于分子量较小的样品检测,Biacore可以说到做到!
在植物科学研究领域,Biacore已经广泛应用到微生物-植物共生、植物抗病性、激素/信号转导、转录调控、表观遗传学、生物与非生物胁迫、翻译后修饰、天然产物活性成分发现与鉴定、农残检测、结构生物学等研究方向或领域,近些年发表的高分文章也如雨后春笋,目前已有数千篇植物科学相关文献发表,成为植物相关科研的必备工具。
1.Matsumoto, H., Fan, X., Wang, Y. et al. Bacterial seed endophyte shapes disease resistance in rice. Nat. Plants 7, 60–72 (2021).
2.Ham, J. H., Melanson, R. A. et al. Burkholderia glumae: next major pathogen of rice? Mol. Plant Pathol. 12, 329–339 (2011).
3.Naughton, L. M. et al. Functional and genomic insights into the pathogenesis of Burkholderia species to rice. Environ. Microbiol. 18, 780–790 (2016).
4.Jung, B. et al. Cooperative interactions between seed-borne bacterial and air-borne fungal pathogens on rice. Nat. Commun. 9, 31 (2018).
5.Miyagawa, H., Ozaki, K. et al. Pathogenicity of Pseudomonas glumae and P. plantarii to the ears and leaves of graminaceous plants. Bull. Chugoku Natl Agric. Exp. Stn 3, 31–43 (1988).

 收藏
收藏 询价
询价