跟骨质疏松说拜拜, RANKL新受体发现让我来

图1 《Nature Medicine》论文
医学顶级期刊Nature Medicine(最新影响因子53.44)刊登了华东师范大学刘明耀教授团队与上海长征医院肖建如教授团队合作完成的题为“LGR4 is a receptor for RANKL and negatively regulates osteoclast differentiation and bone resorption”的研究成果。本研究首次发现破骨细胞中最重要分化因子RANKL的一个新受体LGR4。LGR4的胞外段与RANK竞争性结合RANKL,并在破骨细胞分化过程中抑制经典的 RANK 信号。进一步,在骨质疏松小鼠模型上,LGR4胞外段在治疗上消除了 RANKL 诱导的骨质流失,有效防治了骨质疏松症。因此,LGR4 作为第二个 RANKL 受体,负向调节破骨细胞分化和骨吸收。这不仅对于骨相关疾病基础研究提供了全新的思路,更重要的是这对于开发此类疾病治疗药物有巨大推动作用。Biacore为RANKL新受体的发现与确认提供了核心数据。
在这个研究中,科研人员首先要解决的问题是,LGR4是否直接与RANKL结合。研究人员使用Biacore,将RANKL固定在CM5芯片上,全长LGR4胞外域(NT-LRR17)、截短的LGR4胞外域(NT-LRR14和NT-LRR8)分别作为流动相依次流经芯片表面,检测其亲和力KD(图2)。结果显示,全长LGR4胞外域(NT-LRR17)与RANKL能够结合,并且亲和力高达52.2 nM。截短的LGR4胞外域(NT-LRR14)与RNKL的结合明显减弱(1.527 μM)。而进一步截短的LGR4胞外域(NT-LRR8)与RNKL不结合。Biacore检测结果明确显示,LGR4与RANKL直接结合,且完整的LGR4胞外域对于其与RANKL结合至关重要。通过CO-IP、计算机模拟、荧光共定位等实验也得到相同的互作结论。
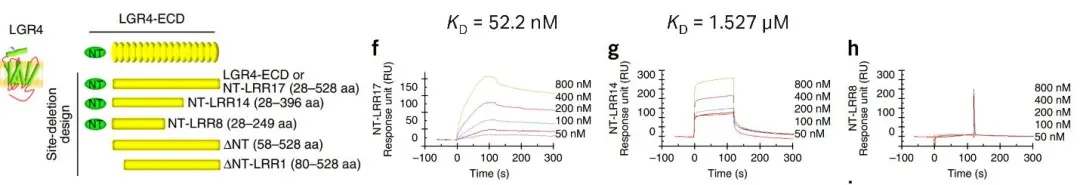
图2 Biacore实验证明,LGR4与RANKL直接结合
为进一步探究LGR4的功能,研究人员获得了lgr4功能缺失突变体,分析发现Lgr4功能缺失降低了骨密度且增强了破骨细胞活跃度,并且LGR4抑制了 RANKL 诱导的破骨细胞分化、存活和功能。进一步研究发现,RANKL与LGR4(一种GPCR)结合,能够激活异源三聚体 G 蛋白信号,阻断 RANKL 诱导的破骨细胞生成。既然LGR4能够阻断破骨细胞的生成,那么含RANKL 相互作用结构域的可溶性 LGR4-ECD (胞外域)蛋白是否可以改善骨质疏松症呢?在四个骨质疏松症小鼠模型中, LGR4-ECD 处理后,降低了破骨细胞活性并增加了骨密度。因此,LGR4-ECD 在体外和体内充当 RANKL 的分子诱饵受体,并抑制 RANKL 诱导的破骨细胞活化和骨质流失,从而有效改善骨质疏松症。
回顾整篇文章(图3),研究人员使用Biacore直接证明了LGR4与RANKL结合,为进一步的研究提供了最重要的基础。接下来,通过对lgr4功能缺失突变体小鼠的表型分析发现,Lgr4功能缺失降低了骨密度且增强了破骨细胞活跃度,并且LGR4抑制了 RANKL 诱导的破骨细胞分化、存活和功能。进一步,对其信号通路进行分析发现,LGR4的胞外段与RANK竞争性结合RANKL,能够激活异源三聚体 G 蛋白信号,阻断 RANKL 诱导的破骨细胞生成。最后,通过对骨质疏松症小鼠模型进行可溶性LGR4-ECD处理发现,外源施加LGR4-ECD能够有效抑制 RANKL 诱导的破骨细胞活化和骨质流失,从而有效改善骨质疏松症。Biacore为整个研究的进行提供了核心数据,首次证明了LGR4胞外域与RANKL直接结合。
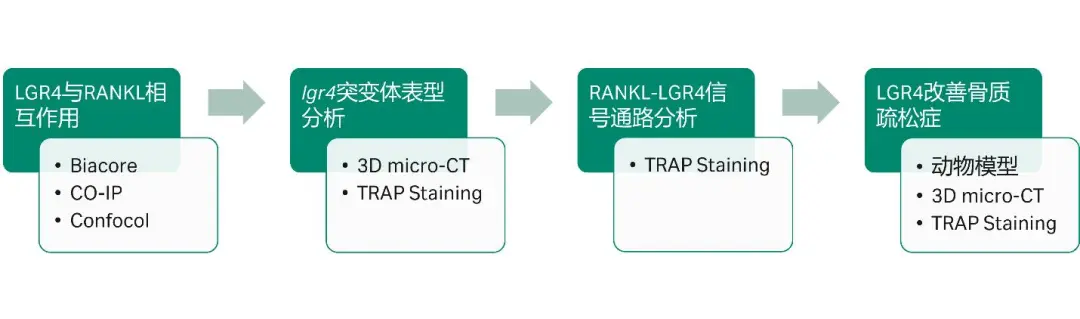
图3 文章整体思路回顾
参考文献:

 收藏
收藏 询价
询价