重磅发现:Biacore助力研发乳腺癌新型三特异性抗体
针对HER2靶点的乳腺癌治疗药物层出不穷,但Trastuzumab依旧牢牢占据C位,是业内公认治疗乳腺癌的首选。可就算是Trastuzumab,依旧存在相当严峻的问题:低反应率,药物抗性明显。例如,由于原发及药物抗性,只有15–30% HER2阳性病人对于Trastuzumab治疗具有反应;HER2低度及中度表达的癌症细胞, Trastuzumab反应效果极小;90%受治疗病人在一年内获得药物抗性。因此,研发具有新型治疗机制的药物,成为攻克全球第一大癌症“乳腺癌”的新方向。
近日,赛诺菲公司等研究团队在Nature杂志发表《A trispecific antibody targeting HER2 and T cells inhibits breast cancer growth via CD4 cells》文章,报道了针对HER2和T细胞的三特异性抗体的研发工作,通过CD4免疫细胞抑制乳腺癌细胞生长,为乳腺癌的治疗提供了新方向。

图1 文章截图
研究人员首先设计出一种由anti-HER2、anti-CD3和anti-CD28组成的三特异性抗体(图2),它们分别靶向、激活并且延长T细胞的生存期。通过图2,我们可以看出该抗体具有紧凑的结合位点结构,因此,此抗体结构中各位点真实的靶向结合能力,以及是否存在多靶点抗原抗体结合相互影响效应,成为研究中首先需要确认的问题。
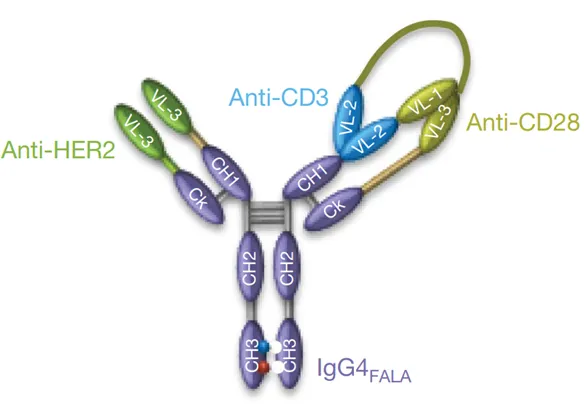
图2 三特异性抗体结构示意图
针对该问题,研究人员使用Biacore,针对于人源、猴源三种抗原分别单独检测其与三特异性抗体的亲和力,通过表1,我们可以看到三特异性抗体与抗原的亲和力大致在纳摩尔级别(人源抗原dissociation constant (KD) = 1.28, 1.0 and 1.43 nM ),显示出该三特异性抗体与对应抗原在单独检测中具有较强的亲和力。
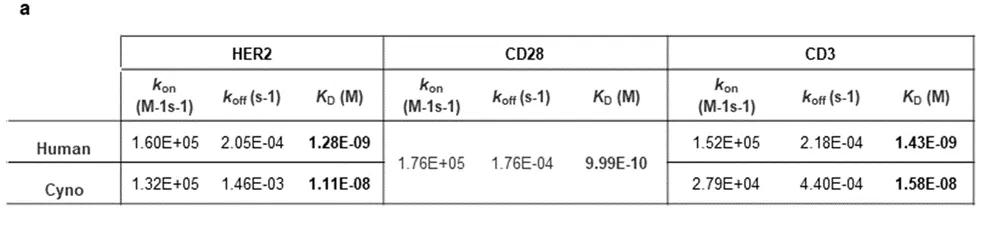
表1 三特异性抗体针对单独的人源、猴源抗原的动力学数据
随后,研究人员继续使用Biacore检测在两种抗原存在条件之下,是否会影响第三个抗原的结合。通过向Buffer添加两种对应抗原,分别检测第三种抗原结合的动力学数据。通过表2 可以看出,与对照组相比,在两种抗原存在条件之下,第三个抗原的动力学数据几乎不变,干扰效应几乎不存在。
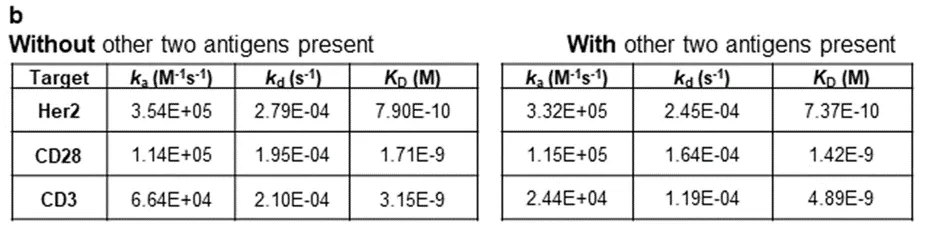
表2 三特异性抗体抗原结合相互影响效应的动力学数据
在后续研究中,研究人员通过T细胞溶解实验、流式细胞术、人源化小鼠模型、猴体内药代动力学研究、猴体内毒理学研究等,获得众多新发现。其中有三点值得着重指出:
- 第一,首次发现 CD4细胞而非CD8细胞是促进肿瘤细胞生长阻滞的关键,CD4细胞通过在细胞周期的G1/S期阻断肿瘤细胞周期进程,并通过促炎细胞因子的合成直接抑制肿瘤细胞的生长。
- 第二,该三特异性抗体能以极低的剂量促进肿瘤消退,而且无论是HER2高表达还是低表达的肿瘤中,该抗体都能够实现有效的肿瘤抑制作用。
- 第三,在猴体内,三特异性抗体使用的耐受性远优于化疗中使用的曲妥珠单抗,心脏毒性也更小。
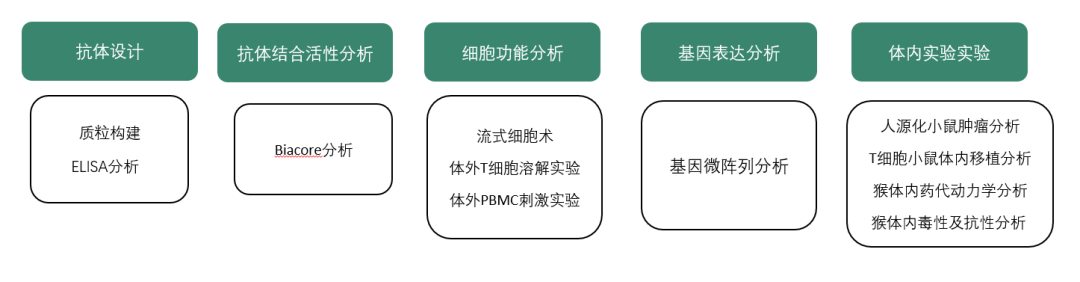
图3 文章研究思路及流程
纵观全文,此次研究涉及到多种分子互作检测技术(ELISA,流式细胞术,Biacore SPR技术),为何在最关键的抗原抗体亲和力测定以及多靶点抗原抗体结合相互影响效应的检测中,唯独使用Biacore来进行检测?
原因就在于:首先, Biacore SPR技术是唯一被中美日多国药典收录,超过80%的上市抗体药都用Biacore进行研发与申报,是公认的分子互作检测金标准,可以给予“一锤定音”的检测定论。其次,相较于传统的分子互作检测技术,Biacore SPR技术具有Real-Time的优势,全程监测分子相互作用发生过程,给予ka,kd,KD等全面数据,加之其高灵敏、高分辨率、无需标签化的检测优势,广受业界好评。
始终以用户需求为导向,不断加强与用户的合作,相信Biacore继续为人类带来更多精彩的科学发现。
参考文献:
1. Seung, Edward et al. “A trispecific antibody targeting HER2 and T cells inhibits breast cancer growth via CD4 cells.” Nature vol. 603,7900 (2022)
2. Pohlmann, P. R., Mayer, I. A. & Mernaugh, R. Resistance to trastuzumab in breast cancer. Clin. Cancer Res. 15, 7479–7491 (2009)
3. Vu, T. & Claret, F. X. Trastuzumab: updated mechanisms of action and resistance in breast cancer. Front. Oncol. 2, 62 (2012)
4. Wu, L. et al. Trispecific antibodies enhance the therapeutic efficacy of tumor-directed
T cells through T cell receptor co-stimulation. Nat. Cancer 1, 86–98 (2020)
2. Pohlmann, P. R., Mayer, I. A. & Mernaugh, R. Resistance to trastuzumab in breast cancer. Clin. Cancer Res. 15, 7479–7491 (2009)
3. Vu, T. & Claret, F. X. Trastuzumab: updated mechanisms of action and resistance in breast cancer. Front. Oncol. 2, 62 (2012)
4. Wu, L. et al. Trispecific antibodies enhance the therapeutic efficacy of tumor-directed
T cells through T cell receptor co-stimulation. Nat. Cancer 1, 86–98 (2020)

 收藏
收藏 询价
询价