实验设计
快速帮您解决工作中遇到的问题

常见问题
实验设计
1. 小分子-蛋白互作
小分子-蛋白互作实验,是选择固定蛋白还是固定小分子?
如果您的实验目的是想获得精确的亲和力数值,那建议选择固定蛋白。考虑到小分子的固定难度、空间位阻以及固定过程对于结合的影响等方面的问题,选择氨基偶联的方式固定蛋白往往是最简单、有效的固定方式。
固定蛋白是选择直接偶联还是捕获法?
- 进行蛋白与小分子互作实验时优先考虑直接偶联蛋白的方式,主要看分子量比值差异。
- 以下情况也可尝试捕获法
- 待固定的样品未经纯化,含有其他杂质;
- 担心直接偶联的过程会影响结合位点等。
- 常用的捕获类芯片以NTA芯片为例,这是一种可以通过螯合镍离子捕获带有His标签蛋白的捕获芯片。NTA芯片上捕获量大约在3000 – 4000 RU最为稳定,非常适合His标签蛋白与小分子二者分子量差异不是特别大的亲和力检测。
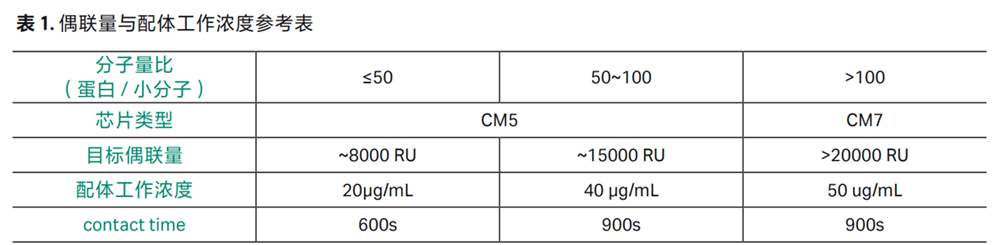
氨基偶联蛋白配体是选择CM5芯片还是CM7芯片,配体的偶联量及使用量如何?
- 当蛋白与小分子的分子量比值大于100时,建议考虑换用CM7芯片。
- 具体使用芯片的类型及使用量可参考下图:
小分子分析物的浓度范围如何确定?
- 蛋白与小分子结合反应的KD值,基本都在μM级别,因此可以将小分子最高浓度设为1000 μM,按照3倍甚至5倍的稀释比例来配制浓度梯度(拉大范围)。
- 进行初步实验后,基本可以确定反应KD值的大致范围,后续可以调整浓度范围、减小稀释比例再进行进一步实验。
- 当然,小分子能够达到的最高浓度还受到溶解度等因素的影响。
如何判断溶剂校正的结果是否正常?
- 按照最常用的分析物在5%的DMSO中为例:对含有5% DMSO的样品以4.5% – 5.8%的范围进行溶剂校正,最终得到的溶剂校正曲线横坐标范围一般要落在-500 到 +1200 RU,校正曲线图谱中的两条竖线代表的是分析物中DMSO浓度范围,要求落在校正曲线的范围内,并且拟合的Chi²值小于2。
- 如果溶剂校正的结果出现异常,可以留意以下几方面的问题:
- 建议使用高品质的DMSO试剂,并且使用相同来源的DMSO溶解小分子和配制所需溶液。
- 注意校正溶液的配制策略,例如只需配制含4.5%和5.8% DMSO的这两种缓冲液,中间梯度通过这两种溶液按照不同比例混合得到,而不需要一个个单独配制。
- 由于DMSO具有吸潮的性质,在配制过程中应及时封闭,避免长时间敞口放置。
- 在上机检测时,也应该对样品管进行密封。Biacore独特的全密闭样品舱设计,及配套专用的孔板封膜及EP管橡胶盖就在此刻表现效果极佳。
小分子不溶于DEMO,但是溶于乙醇,请问乙醇可以做Biacore实验吗?需要校正吗?
可以使用Biaocre来检测,也需要做溶剂校正,做法和DMSO一致,但要注意乙醇较易挥发问题,配置试剂要迅速。
分析物的缓冲液环境中含有海藻糖、甘油等高折光的物质?
- 置换buffer,置换掉高折光物质
- 稀释倍数在100倍以上,可以先进样试试,当然最好还是要置换buffer。
分析物的缓冲液环境中含有DMSO等有机溶剂?
Biacore具有溶剂矫正功能,对于需DMSO助溶的小分子样品,同样在running buffer中加入与分析物中相同浓度的DMSO,通过溶剂矫正即可获得真实结果。
2. 蛋白-蛋白互作
直接偶联抗原或抗体,偶联量分别为多少适宜,偶联量偏高或偏低对分析亲和力结果各有什么影响?(固定抗原还是抗体,固定量多少合适)
- 根据RL=Rmax*MWligand/MWanalyte/Sm计算,Rmax设为100-200。
- 偶联偏高会使结合速率ka,解离速率kd都测不准.
分析物的浓度梯度应该如何设置?
- 浓度梯度的设置在0.1-10KD之间
- 常见生物分子间相互作用的亲和力如下范围

- 针对于动力学结合趋势,能够达到饱和趋势的浓度设置是我们想要的。但是,针对于某些超高亲和抗体而言,结合段往往想要达到饱和趋势并不容易,因此针对于这类样品,我们不用刻意追去饱和浓度,应更在意图谱规整和QC参数。
- 实验结果还需要从图谱和QC来判断。如果图谱正常、QC灯显示合格,结果也是不错的。
配体蛋白带标签(例如:His、GST、biotin、avi等),检测相互作用时标签会不会影响检测结果?
- 这一类标签明显干扰到检测的可能性很低。
- 对此,需要在方法中明确说明样品是否带有标签。此外,阳参样品的验证是最好的说明。
- 可使用纯的标签蛋白做阴性对照实验。
要氨基偶联的配体中有Tris 等含有伯氨基的成分?
氨基偶联是通过配体氨基与芯片表面羧基来完成偶联的,配体中含有tris等成分会对氨基偶联产生影响。
解决方案:
- 置换buffer,去除Tris等含有伯氨基成分的分子。
- 看具体浓度多少,Tris小于50mM时影响不大,可以实验。
3. 捕获法
捕获法测亲和力,抗体母液里含有0.01%吐温80会影响实验结果吗?
样品中含有去垢剂理论上没有影响,本身Running buffer就有表面活性剂,捕获实验过程中ligand还要用running buffer稀释,再进行试验。
纯度只有60%的蛋白,但是有his-tag,可以用his捕获吗?会不会影响分析物结合效果?
如果是大分子的实验,用anti his antibody捕获是可以的;Biacore可以完成对非纯化样品的互作检测,anti-his的方案可完成初步纯化,进而完成后续互作实验。
4. 再生条件
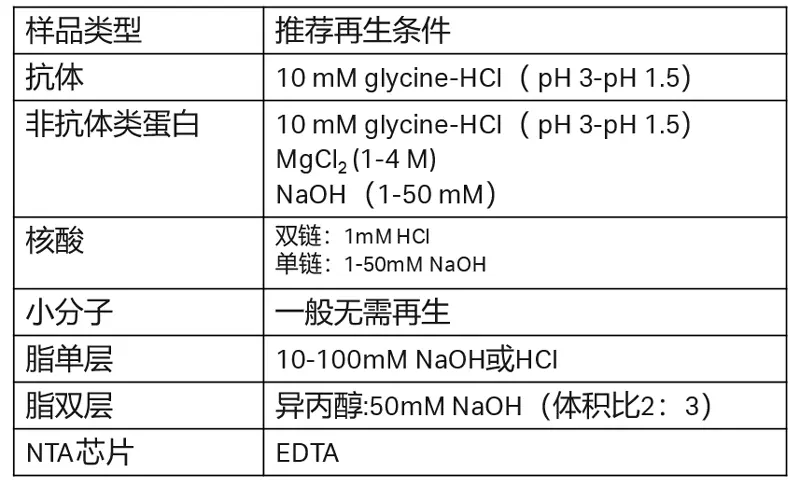
在摸索再生条件时,不同类型的再生buffer,如NaOH,Glycine-HCl,高盐buffer,有机buffer等再生效果由弱到强如何排序,对芯片的损害程度情况如何?
- 可使用Regeneration scouting程序,对再生试剂进行测试,选择最合适的
- 捕获法有对应推荐的再生条件,可参照相对应的捕获试剂盒说明书或如下表格

- 常用的再生试剂选择
涉及到小分子实验的时候,为什么不用再生?如果真有再生不彻底的小分子,如何处理?
- 这一类标签明显干扰到检测的可能性很低。
- 一般而言,小分子与蛋白的结合稳定性相对较弱,在解离阶段小分子和蛋白很容易发生解离,无需再生。

 收藏
收藏 询价
询价