胞内特定蛋白糖基化修饰新工具:双特异性RNA适配体
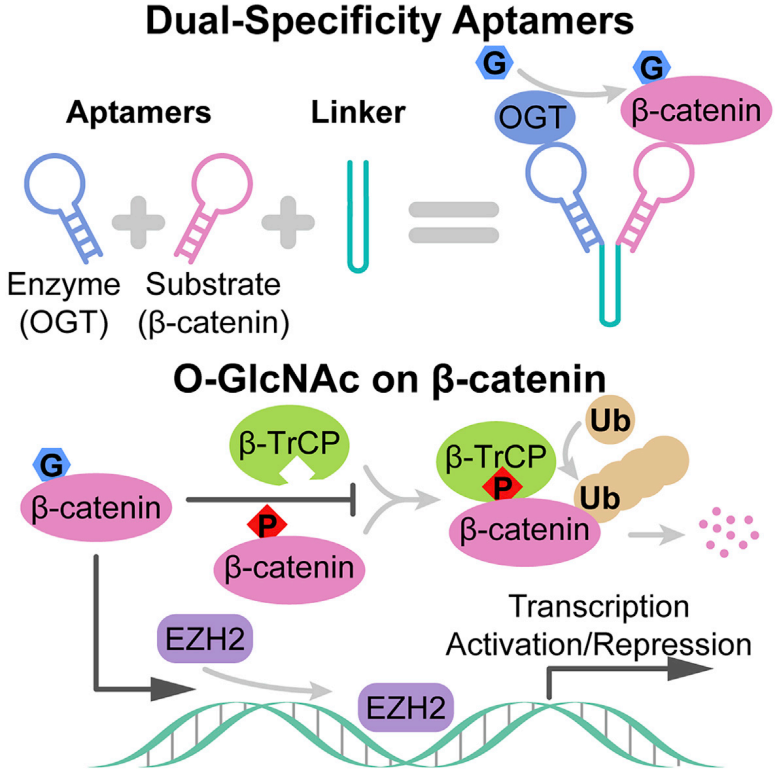
图1:原文图片摘要
01. ncOGT适配体
O-GlcNAc转移酶 (OGT) 催化糖分子与蛋白质氨基酸残基的共价结合,形成糖蛋白。核酸适配体是一类短的单链核酸,可以高特异性、高亲和力地结合靶点,通常利用SELEX获得。为了不影响OGT本身的活性,作者避开ncOGT的活性位点,得到了以TPR结构域为靶点的适配体T1。作者分别使用Biacore、RNA-IP验证T1与ncOGT在体外、细胞内的结合活性。SPR实验可以看出,T1与全长OGT的亲和力达到了60 nM,与单独TPR结构域的亲和力相当。从SPR传感图还可看出,T1与靶点呈现出慢解离的现象,拟合得到的解离速率也验证了这一点。酶活实验证明了T1并不影响ncOGT的糖基化活性。
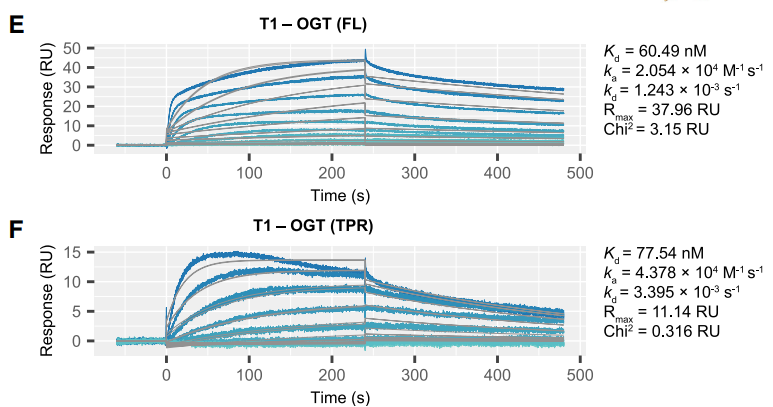
图2:使用Biacore检测OGT适配体与靶点亲和力
02. ncOGT/GFP双特异性适配体
为了得到双特异性适配体,作者使用linker将T1与GFP的适配体AP3连接起来,得到NL1F双特异性适配体。IP及WB实验证明,NL1F可以有效地提高GFP-β-catenin的O-GlcNAc糖基化水平,并且内源β-catenin糖基化并未受到影响。Linker的不同会改变适配体间的距离、取向,影响双特异性适配体的活性。作者通过linker的优化设计,将GFP-β-catenin的O-GlcNAc糖基化水平最高提高了15倍。这一作用在GFP标记的其他外源蛋白上同样有体现,说明NL1F双特异性适配体研究其他外源蛋白的适用性。
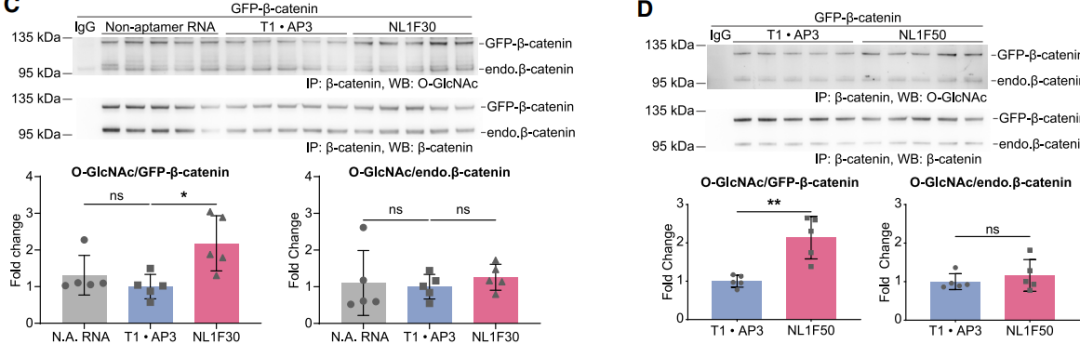
图3:双特异性适配体提高GFP-β-catenin糖基化水平
03. ncOGT/β-catenin双特异性适配体
图4:Biacore检测β-catenin与适配体亲和力
基于此双特异性适配体方法,作者发现β-catenin的O-GlcNAc糖基化可以通过抑制与β-TrCP的结合来维持稳定,O-GlcNAc糖基化还可以增强β-catenin与EZH2的结合,招募其到启动子区域,极大地改变了转录组,说明了双特异性适配体在蛋白糖基化功能研究中的重要作用。
看到这里,是不是打开了研究新思路呢?而本文除了研究思路独辟蹊径外,在Biacore实验中也有巧思:合成NH2-T24 DNA linker,将其偶联在芯片上,然后利用此linker作为“捕获分子”捕获RNA适配体,再检测适配体与靶点的动力学/亲和力,最终使用NaOH即可将芯片上的适配体全部洗去,芯片可继续用于其他适配体的Biacore实验。
小结:
Biacore精准的动力学/亲和力检测,在适配体开发中除了能表征亲和力的强弱,更能提供适配体-靶点结合稳定性等重要参数。适配体的开发中随处可见Biacore的身影:基于步进型组合文库的post-SELEX策略优化、HCC早筛慢解离适配体开发、非小细胞肺癌标志物检测……
双特异性适配体、双特异性抗体、ADC、PROTAC,生物分子的花样组合总带来不一样的创新,而创新离不开灵活的研究思路、巧妙的实验设计和可靠的实验工具。分子互作金标准Biacore将一直以严谨的实验设计、超高的灵敏度、广泛的样品适用性为科学家提供坚实、可靠的实验数据。
Zhu and Hart, Dual-specificity RNA aptamers enable manipulation of target-specific O-GlcNAcylation and unveil functions of O-GlcNAc on b-catenin, Cell (2023), https://doi.org/10.1016/j.cell.2022.12.016

 收藏
收藏 询价
询价