长效抗体开发新策略
血清白蛋白的相关研究解读
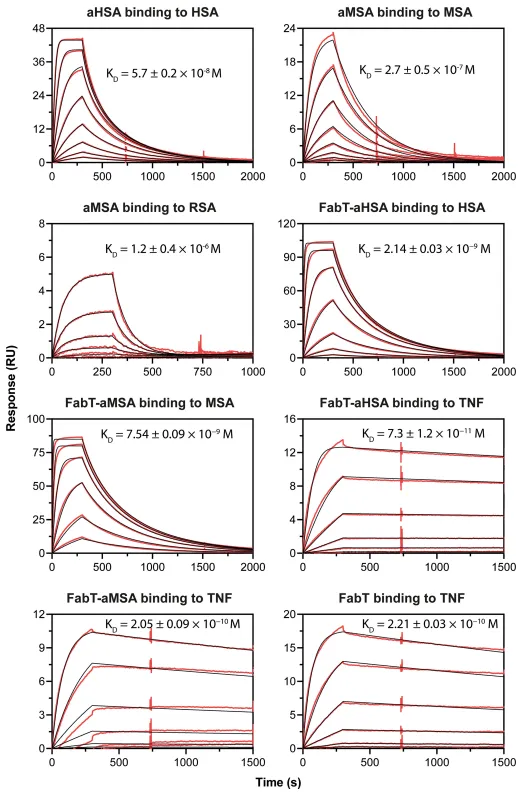
图1:Biacore检测aHSA和aMSA与FabT framework III fusions的亲和力/动力学数据
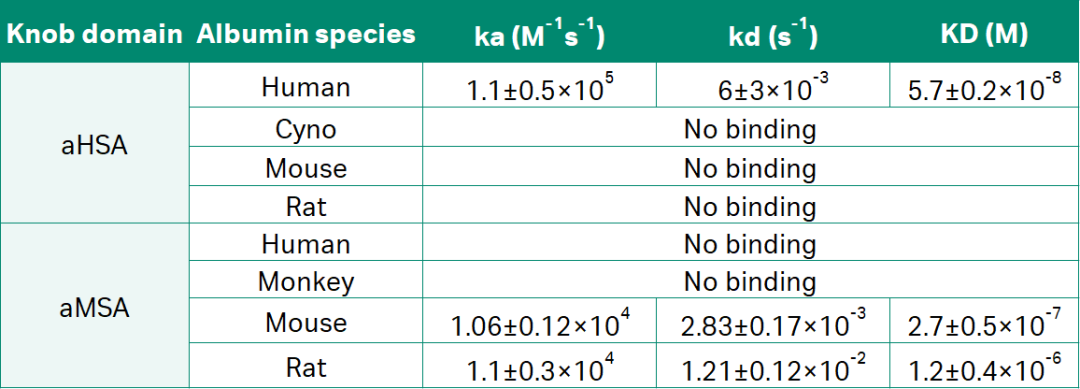
表1:Biacore检测aHSA和aMSA旋钮结构域的抗原结合动力学
已有研究表明,由于血清白蛋白的丰度,即使与配体的亲和力是µM级别也能够在体内实现适当半衰期 (t1/2) 的延长。因此,作者假设更短的血清白蛋白的knob domain可以更有效地延长蛋白或肽的半衰期,所以作者据此设计了重组的FabT片段并检测了其结合动力学。
Biacore 8K+实验结果显示,FabT-aHSA结合HSA的亲和力为2.1 nM,TNFα结合HSA的亲和力为73 pM。FabT-aMSA结合MSA的亲和力为7.4 nM,与TNFa结合的亲和力为205 pM。未修饰的FabT片段结合TNF亲和力为221 pM,不结合HSA或MSA(如图1和表2所示)。并通过药代动力学 (PK) 的检测确定通过这一方法已经实现半衰期的延长。
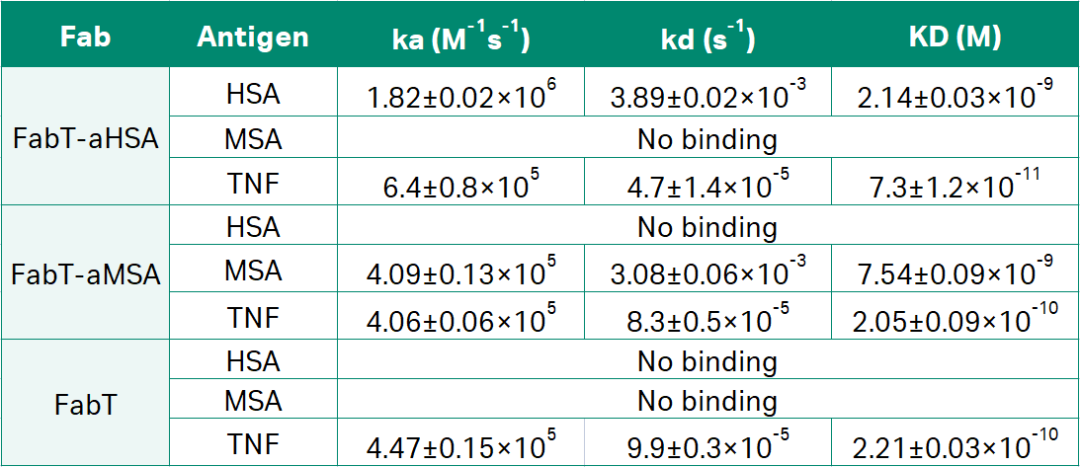
表2:Biacore检测FabT- aHSA、FabT- aMSA和FabT与其抗原的结合动力学
作者在设计了重组Fab片段后,又进一步对嵌合肽进行了化学修饰。已发表的HAP肽被用作aMSA和aHSA knob domain的抑制有效载体。HAP肽以nM亲和力结合IL-17A同源二聚体,从空间上阻止与IL-17RA的结合并阻断信号传导。于是作者又利用Biacore检测修饰后的嵌合肽的结合动力学,发现aHSA-HAP结合HSA的亲和力为40 nM, aMSA-HAP结合MSA的亲和力为370 nM,与分离的白蛋白结合肽相当(如图2A和表3所示)。aHSA-HAP和aMSA-HAP结合IL-17A,亲和力分别为248 nM和275 nM(如图2B和表3所示)。
与此同时,作者也使用了Biacore进行了竞争实验的测试。将IL-17RA固定在CM5芯片上,当单一浓度的HAP肽 (250 nM) 存在时,其相互作用基本上被消除(如图2C所示)。
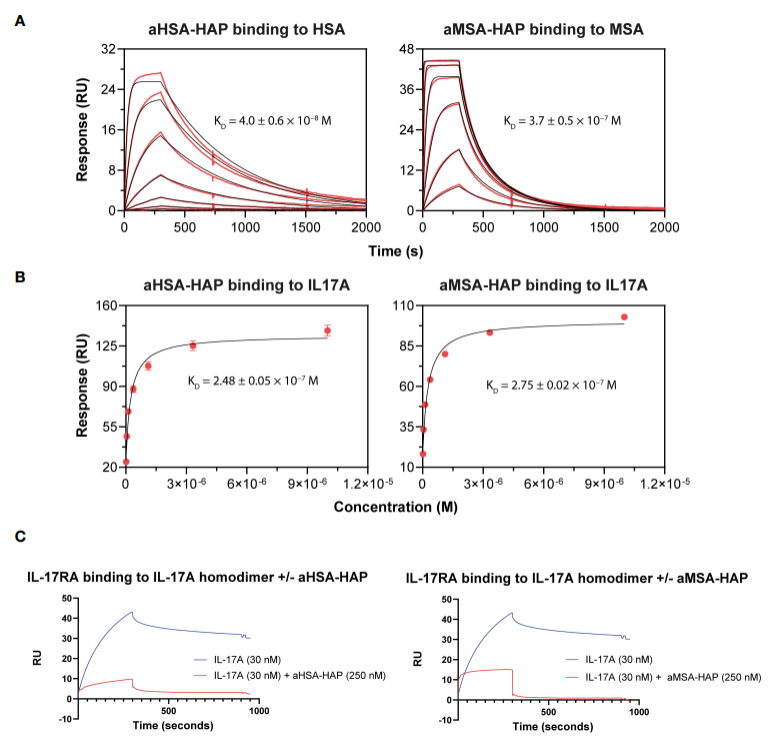
图2:Biacore检测嵌合肽的动力学
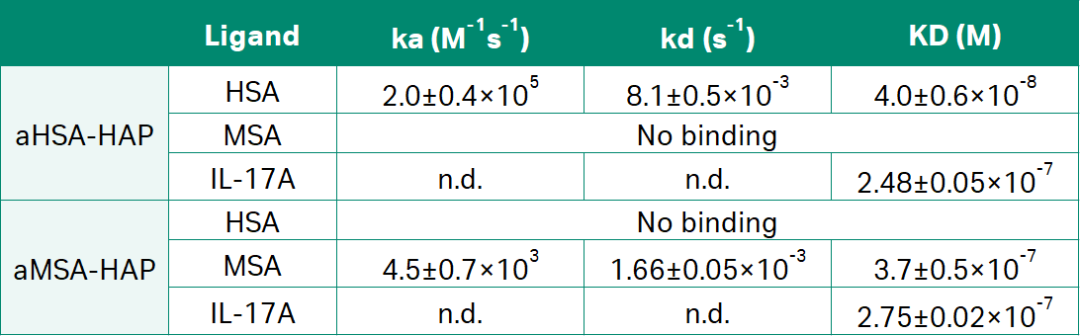
表3:Biacore检测aHSA-HAP和aMSA-HAP的亲和力/动力学
综上所述,作者利用Biacore实验说明了knob domain作为化学和重组蛋白工程工具的实用性。并说明了VH framework III loop可以作为嫁接该结构域的可行位点,以创建双特异性或潜在的双异位抗体。
Biacore作为生物分子相互作用领域的检测 “金标准” ,被同时收录进中、美、日三国药典中,成为唯一被三国药典所收录并推荐使用的非标记分子互作技术。至今为止,85%以上已上市的抗体药物都在药物研发、申报、生产质控、批次放行等生产过程中都大量使用到了Biacore。相信Biacore会与各位一道继续助力抗体药物的上市。
Adams R, Joyce C, Kuravskiy M, Harrison K, Ahdash Z, Balmforth M, Chia K, Marceddu C, Coates M, Snowden J, Goursaud E, Ménochet K, van den Elsen J, Payne RJ, Lawson ADG, Scott-Tucker A, Macpherson A. Serum albumin binding knob domains engineered within a VH framework III bispecific antibody format and as chimeric peptides. Front Immunol. 2023 May 12;14:1170357.

 收藏
收藏 询价
询价