新火花! Biacore与冷冻电镜,揭示PI3Kα全新药物结合位点
越来越多的PI3Kα抑制剂在临床试验上取得突破性进展,但目前可用的PI3Kα小分子抑制剂不能区分野生型蛋白 (WT) 和癌突变体蛋白,因此它们同时也会抑制WT酶维持基本生命的活性,带来的高毒性等副作用,使其成为应用于临床所面临的巨大挑战。因此,识别突变体特异性位点,并基于此位点进行药物设计至关重要。
023年下半年,复旦大学基础医学院王明伟讲席教授、美国Scripps研究所Peter K. Vogt院士和中国科学院上海药物研究所杨德华研究员合作在《美国国家科学院院刊》上发表了题为“Structural insights into the interaction of three Y-shaped ligands with PI3Kα”的研究成果(图1),研究人员通过冷冻电镜分别解析了PI3Kα与三种Y型配体(Cpd16、Cpd17和Cpd18)复合物的结构,并用Biacore的亲和力结果与之相互验证,揭示了之前未曾报道的特殊配体结合口袋(空间上靠近ATP结合位点),为靶向PI3Kα的药物设计提供了新的思路。

图1:复旦大学和中科院上海药物所等发表在PNAS上的科学研究论文
Biacore助力PI3Kα相关研究
首先,他们分析了Cpd17–PI3Kα的冷冻电镜结构,结果显示Cpd17以Y型构象结合在PI3Kα上,其中一条侧链(2,3-二甲基喹喔啉-6-羧酰胺)插入到先前未知、由R770和W780形成的“三明治”型口袋,形成强烈的π-π和cation-π相互作用;另一条侧链(6-(2-苯基乙炔基)喹喔啉)则以独特角度插入ATP结合位点,与PI3Kα形成丰富的疏水和堆叠作用。进一步,研究人员通过Biacore实验验证了Cpd17与PI3Kα的强亲和力,二者的亲和力KD高达347 nM(图2)。
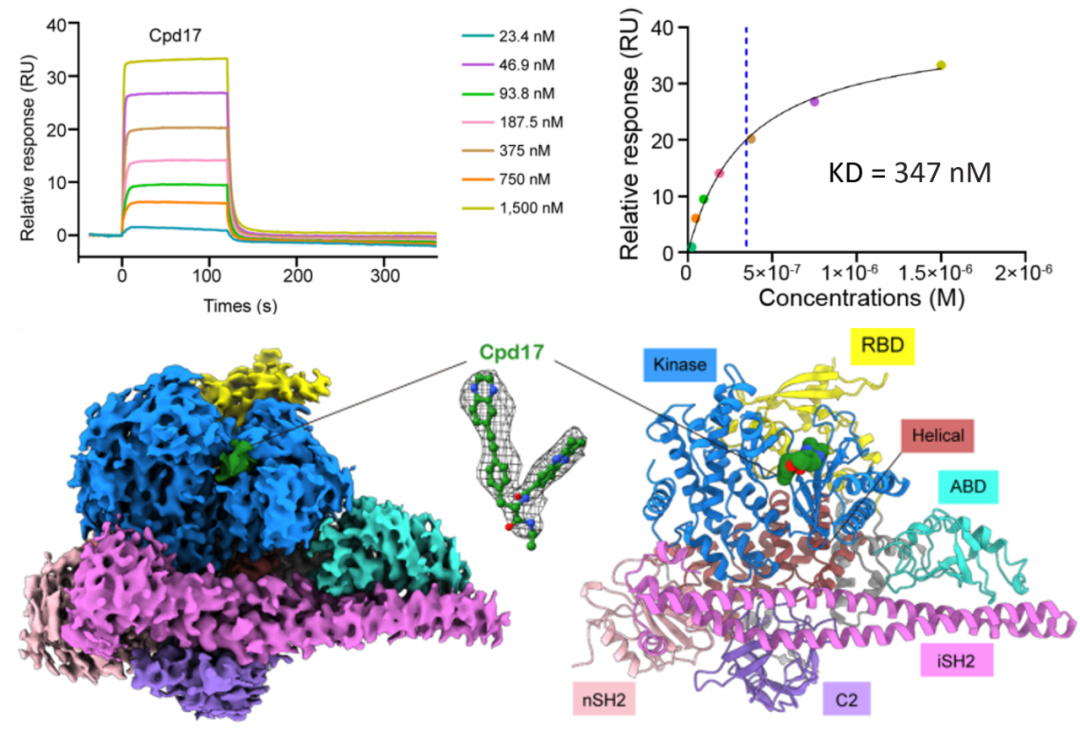
图2:Biacore检测PI3Kα与Cpd17的亲和力以及PI3Kα-Cpd17复合体的冷冻电镜结构
cpd16是cpd17的S型对映异构体,Cpd16的手性差异使得其氨基酸尾部旋转以致略微远离PI3Kα,从而减少了与后者相互作用之面积,降低了二者的亲和力。Biacore结果与之完全一致,Cpd16与PI3Kα的亲和力稍微降低,降低了约3倍,是915 nM (图3)。cpd18是cpd17的间异构体,Cpd18的苯环间位取代使Y型中心叔碳往远离P-环方向位移2.5 Å,引起6-(-苯基乙炔基)喹喔啉和2,3-二甲基喹喔啉-6-羧酰胺分别旋转67.6度和27.4度,因此无法与S773和V851等形成氢键,与R770的堆叠和M772的疏水作用也明显下降,由此显著下降了同PI3Kα的亲和力。Biacore结果与之完全一致,相较于Cpd17与PI3Kα的亲和力,Cpd18与PI3Kα的亲和力显著降低,降低了约28倍,只有9930 nM(图3)。对于三种不同亲和力的Y型配体(Cpd16、Cpd17和Cpd18)复合物的深入研究,阐明了立体或区域化学修饰引起亲和力差异的结构基础,为靶向PI3Kα的药物设计提供了新的思路。
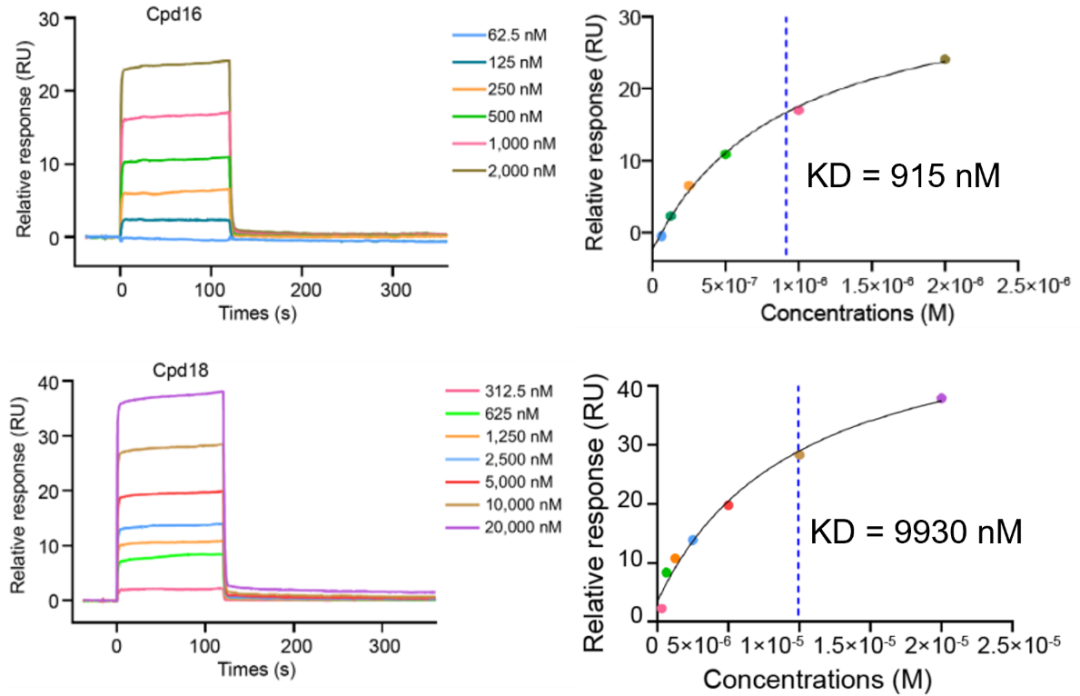
图3:Biacore检测PI3Kα与Cpd16、Cpd18的亲和力
小结:
作为冷冻电镜的黄金搭档,Biacore还将持续助力更多结构的解析以及结构生物学的发展。不仅在结构生物学与药学领域,Biacore广受欢迎,其实Biacore已广泛应用到基础科研与药物开发的多个领域。截至目前,借助Biacore累计发表的文章已突破60000篇,超过100种的已上市药物的研发、申报、生产过程中也均有Biacore的身影。同样期待越来越多新的结合位点被发现并基于这些位点开发出更多优质的药物,助力人类健康事业。
Zhou, Qingtong et al. “Structural insights into the interaction of three Y-shaped ligands with PI3Kα.” PNAS vol. 120,34 (2023): e2304071120.
Favalli, Nicholas et al. “Stereo- and regiodefined DNA-encoded chemical libraries enable efficient tumour-targeting applications.” Nature chemistry vol. 13,6 (2021): 540-548.

 收藏
收藏 询价
询价