号外!号外!Biacore爆出CAR-T设计惊天大秘密!
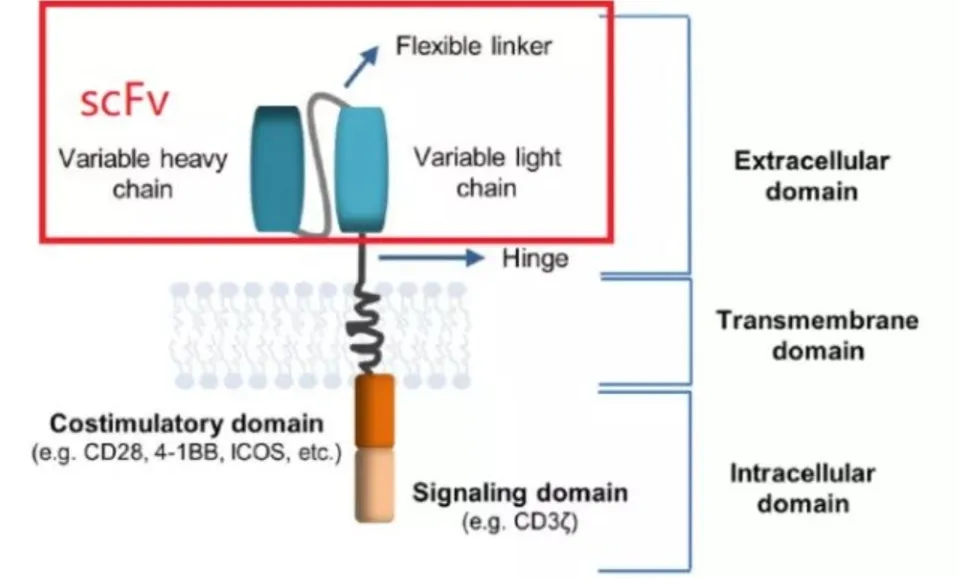
图1.五代CAR-T的结构示意图
亲和力是否越高越好?
在文章中选择了一个与FMC63(Kymriah和Yescarta使用的CD19 scFv)结合表位类似的CD19 scFv序列,并将其命名为CAT。通过Biacore检测发现其亲和力KD低2个数量级,CAT对CD19的低亲和力主要体现在kd上,(CAT, 3.1×10−3 s−1 ; FMC, 6.8×10−5 s−1 )也就是解离速度,而ka表征的结合速率与FMC63相当(CAT,2.2×105 M−1 s−1 ;FMC, 2.1×105 M−1 s−1 )。FMC63和CAT与CD19上相同或重叠的表位结合,且热稳定性和细胞表面稳定性相似。
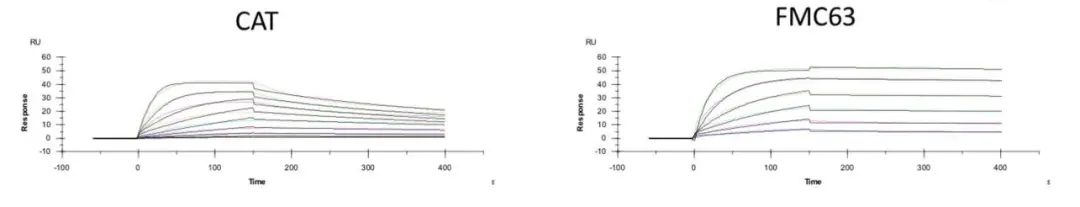
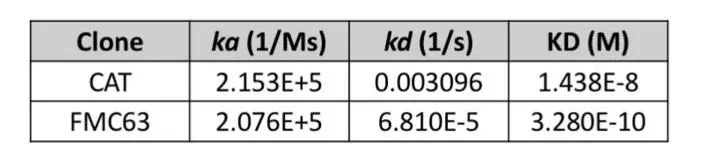
图2.不同CD19 scFvs与CD19结合的动力学结合数据
拥有合适亲和力的CAR可以提高其特异性并减少“在靶点、肿瘤外”副作用,当靶标抗原在健康组织上普遍表达时,这一点尤其重要。亲和力的适当降低可以影响CAR信号传导和其他效应器功能,如细胞因子分泌、增殖和持久性。在细胞治疗等肿瘤免疫疗法的研发过程中,scFv的抗原亲和力毫无疑问是一个非常关键的检测和控制指标。随着研究的深入,我们逐渐意识到免疫受体相关的亲和力不是简单的越高越好,而是在一定的范围内才会发挥最大的治疗效果。
CAR-T选择scFv时多大的亲和力合适?
CAR-T细胞治疗实体瘤尚存在诸多挑战。为了应对这些挑战,Moonsoo Jin的团队/AffyImmune公司在第一代CAR-T细胞的基础上进一步优化,通过调节其亲和力,以及增加CAR-T细胞示踪技术,开发了新一代ICAM-1 CAR-T细胞产品(编号AIC100)。AIC100于2021年5月进一步获得FDA快速通道资格,意味着FDA允许快速开发和审查该候选药物。
其研究结果发表于2017年10月的Scientific Reports上,Jin博士等人通过对LFA-1(ICAM-1的天然受体)的研究,发现了一系列LFA-1亲和变体,这些亲和变体与ICAM-1(天然配体)的结合亲和力最多相差一百万倍。靶向ICAM-1的微摩尔亲和CAR-T细胞实现了小鼠肿瘤的快速消除,同时避免了全身毒性。
实验人员使用来源于 LFA-1 的 I 域构建了靶向于 ICAM-1 的 CAR 突变体,I结构域中的各种活性结合位点先前已被分析出来,这些突变点位于结合界面之外,该结合界面包括称为金属离子依赖性粘附位点(MIDAS)的区域。通过封闭到逐渐开放I结构域来诱导对ICAM-1的亲和力的逐步升高。其中亲和力检测传统的互作分析方法已经不足以满足其需求,这些方法只能对分子间的结合有无做初步定性研究,而具体到分子间结合的强弱、快慢等定量比较亲和力和动力学的差异,特别是阐明蛋白不同位点的氨基酸的突变对于互作的影响时,还是需要高灵敏度、高分辨率、数据精准的Biacore来完成。通过Biacore测量其亲和力,ICAM-1 与单个 I 结构域变体的单价亲和力跨越大约六个数量级 (KD ~1nM 至 1mM)。
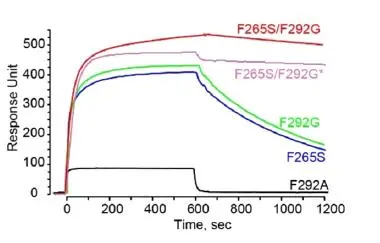
图3. 固定人 ICAM-1检测与 I 结构域变体亲和力的传感图
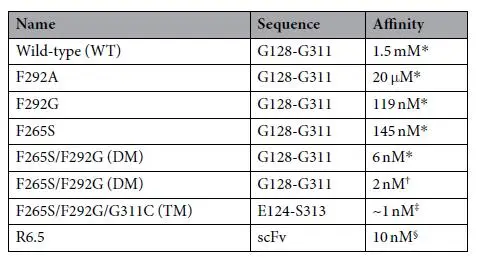
表1:LFA-1 I结构域与ICAM-1的亲和力测定数据
随后他们使用具有不同抗原密度的靶标,评估了具有106倍亲和力差异的各种突变体的结构活性关系,结果显示,具有微摩尔亲和力的AIC100在非临床动物模型中显示出最佳效果。临床前研究表明,微摩尔亲和力的CAR-T细胞具有更高的体内抗肿瘤活性和安全性。AIC100单次给药能够使肿瘤消除,并显著改善ATC异种移植动物的存活率。
这种降低CAR亲和力的设计在更多研究中得到了证实。开发针对癌胚抗原glypican 3(GPC3)的CAR-T时,阿斯利康公司的研发人员从各方面比较了带有低亲和力和高亲和力单链可变片段(scFv)的CAR。
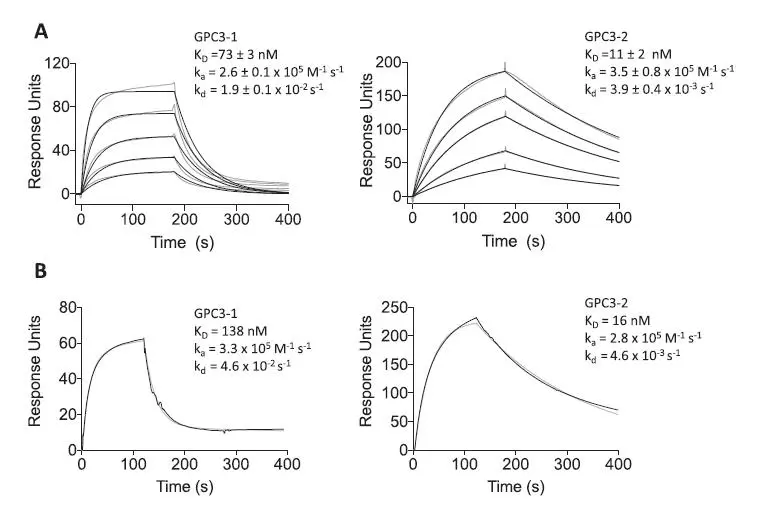
图4.使用SPR检测GPC3与CAR亲和力传感图(A)人(B)小鼠
研究人员通过噬菌体展示的方式发现了抗体GPC3-1。GPC3-1的SPR结果显示与 GPC3 结合的 KD 值为 73 nM。通过将 GPC3-1 VL与从噬菌体库中分离的另一抗体交换VL 结构域,产生了比GPC3-1 更高亲和力的变体 GPC3-2。研究人员使用Biacore检测出GPC3-2的亲和力为11 nM。GPC3-2 更高的亲和力主要是由于解离速率比 GPC3-1 低 5 倍的结果。这两种 scFv 以相似的动力学与小鼠 GPC3 结合。因为 GPC3-1 和 GPC3-2 共享一个 VH 序列,所以预测它们有相同的结合表位,后续的实验也证实了这一点。Biacore 8K不止可以进行亲和力/动力学的检测,其软件内置epitope binning实验与分析模块,能够更快、更好地展现配对分析的结果,帮助科研人员从结合特异性,亲和力,动力学到结合表位多个维度,全方位的去表征scFv,加速研发进程。
在随后的研究中他们发现,高亲和力CAR-T细胞在体内有明显的毒性。而低亲和力CAR对抗原阳性肿瘤细胞保持细胞毒性功能的同时,对正常组织没有毒性。高亲和力CAR诱导的毒性是由靶向非肿瘤组织引起的,因为高亲和力CAR-T在非荷瘤小鼠中也引起毒性,并迁移到GPC3低表达的器官中。
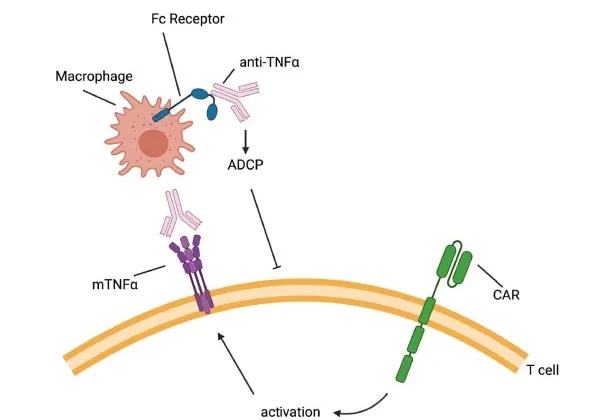
图5.在golimumab存在下活化的CAR-T细胞的mTNF依赖性耗尽的作用机制。
为了控制CAR-T毒性,他们开发了一种方法,使用抗TNF-α抗体疗法靶向并消除CAR-T细胞。该抗体通过消除早期抗原激活的CAR-T细胞发挥作用,但对CART细胞的抗肿瘤活性影响很小。通过将亲和力降低的CAR与这种外源性控制方法相结合,他们实现了调节和控制CAR介导的毒性的目的。
高亲和力可以带来快速细胞激活和升高的杀伤力,但却很快产生细胞的耗竭、凋亡和失活。反而,低亲和力或俗称“飞吻”模式结离的CAR-T更能发挥持久的抗癌作用。通过以上几篇Biacore应用文献我们不难发现,研发人员在针对CAR的研究中,对于亲和力的追求已经向更全面,更准确的要求发展,不仅仅需要知道其亲和力,动力学特征也极其重要。传统的筛选方法因为是终点技术,只能获得亲和力,无法获得解离速率等动力学数据。并且还存在着检测精度差,通量低、数据单一等问题,已经无法满足现代药物研发中的要求。相比传统方法,Biacore可以大大提高抗体筛选效率和准确性,实现粗上清、腹水等的直接检测。Biacore可以实现超过72小时无人值守,同时提供动力学和亲和力数据。更为重要和方便的是,在采用Biacore技术进行初筛的同时,还可以同时对抗体的表达量进行定量,即将浓度定量与筛选实验合二为一,大大简化了早期筛选的实验流程。
Biacore作为药典收录的分子互作技术,在抗体的结合活性、活性浓度、热稳定性等检测和研究中发挥了巨大作用。基于SPR技术的Biacore设备符合GxP和21 CFR Part 11的合规要求,涵盖靶标抗原的选择,高通量筛选与表征,表位作图,抗体改造,一致性评价,免疫原性,PK/PD和生产质控等各个环节,准确稳定的数据质量得到了药企和监管机构的的广泛应用和认可,为加快新药上市保驾护航。

 收藏
收藏 询价
询价