Biacore案例集锦:外泌体互作检测深度解析
外泌体是一类细胞产生的细胞外囊泡 (EVs) ,直径约40~160 nm,它们携带核酸、蛋白质、脂质和代谢物,是细胞间的通讯介质,影响细胞生物学的各个方面[1]。人体几乎所有类型的细胞在正常及病理状态下均可分泌外泌体,外泌体广泛分布在如血液、唾液、尿液、脑脊液和乳汁等。
由于外泌体等EVs具有高生物利用度、生物稳定性、靶向特异性、低毒性和低免疫原性,其在疾病诊断、治疗及药物递送中极具潜力。Biacore作为分子互作“金标准”,研究EVs当然也离不开ta。
01. 工程化外泌体逆转肿瘤免疫治疗中的T细胞衰竭
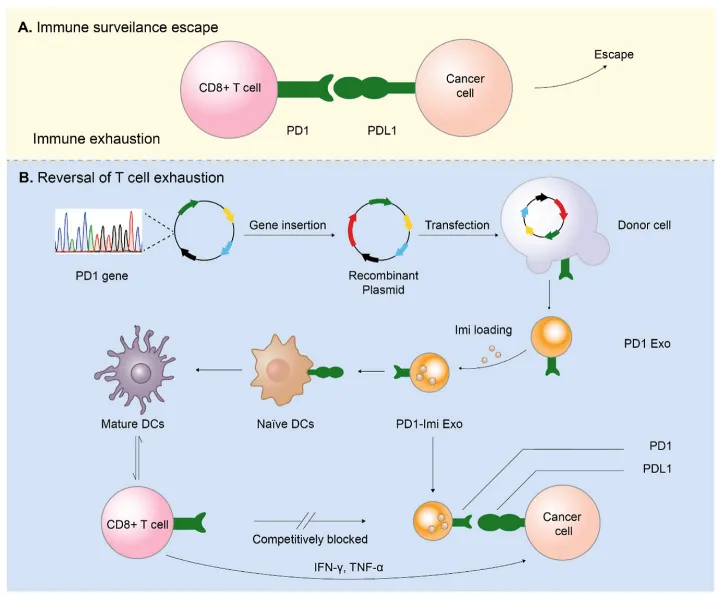 图1:工程化外泌体PD1 – Imi Exo研究路线及作用机制
图1:工程化外泌体PD1 – Imi Exo研究路线及作用机制
为了验证PD1 Exo与PDL1的直接结合,作者>使用Biacore分别测定了PDL1与PD1蛋白及与PD1 Exo的结合(图2)。作者首先将PDL1蛋白偶联在>CM5芯片上,PD1蛋白或>PD1 Exo作为分析物,测定结合变化。结果表明,>相较于PD1蛋白,PD1 Exo与PDL1的亲和力提高了数百倍。而除了亲和力信息外,>Biacore实时检测的特点可以获得二者的>结合速率和解离速率信息,>相较于PD1蛋白,PD1 Exo与PDL1的解离明显变慢,说明其与PDL1的>结合更加稳定,预示着其可能具有较长的药效。
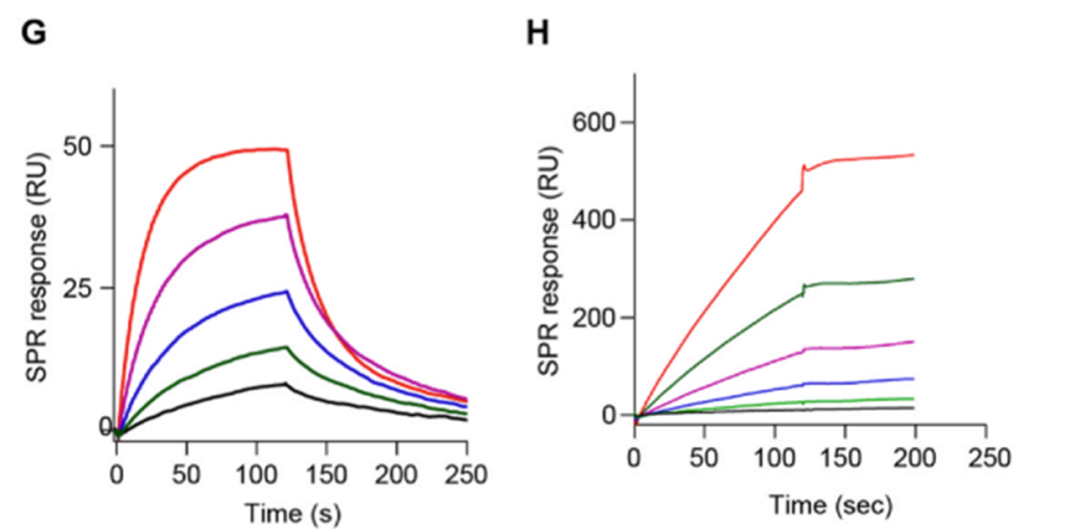
图2:Biacore检测PDL1与PD1蛋白 (G) 与PD1 Exo (H) 的结合
文中实验还表明,PD1 – Imi Exo呈水泡状圆形(约139 nm),对肿瘤细胞和树突状细胞均有明显的靶向作用和较强的结合作用,对黑色素瘤小鼠和乳腺癌小鼠均有显著的治疗效果。本研究也为提高PD1/PDL1的治疗效果,通过重建患者的免疫功能来预防术后肿瘤复发或转移,从而巩固整体预后提供了一种有希望的新策略。
02. 抗体组装EV方法研究
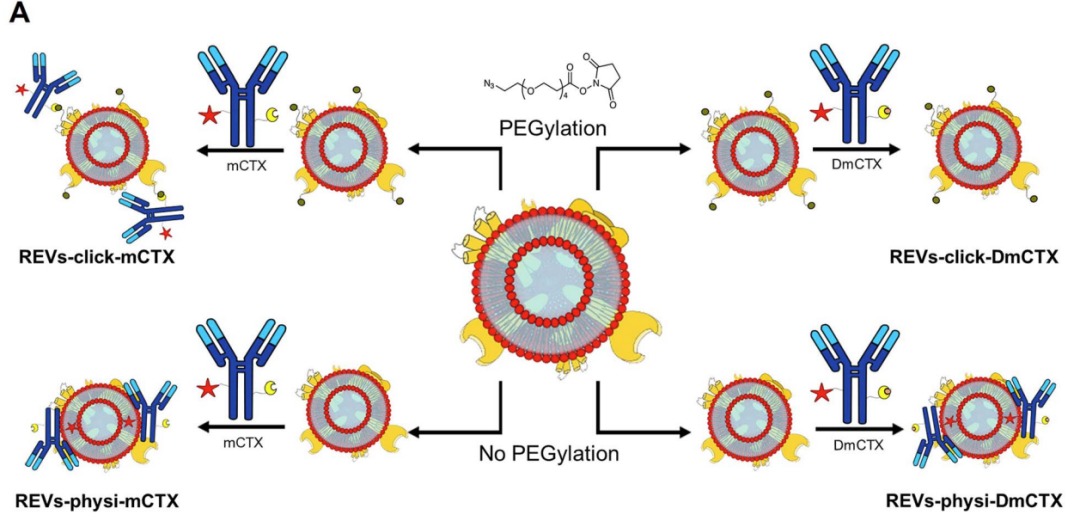
图3:抗体EV组装方法示意图
作者使用Biacore X100,将EGFR偶联在CM5芯片上,分别检测了EGFR与EGF、CTX、mCTX (modfied CTX) 、天然REVs、四种工程化REVs的亲和力。EGF、CTX与EGFR的亲和力均与文献报道相符 (67.3nM、1.8nM) ,而化学修饰则使CTX的亲和力降低,mCTX亲和力为3.6nM。在检测EGFR与外泌体的结合时,首先天然的REVs未观察到结合信号,化学吸附的REVs-click-mCTX的亲和力为0.17nM,高于mCTX十倍,且呈现典型的慢解离过程,物理吸附的外泌体REVs-physi-mCTX亲和力与REVs-click-mCTX相当。
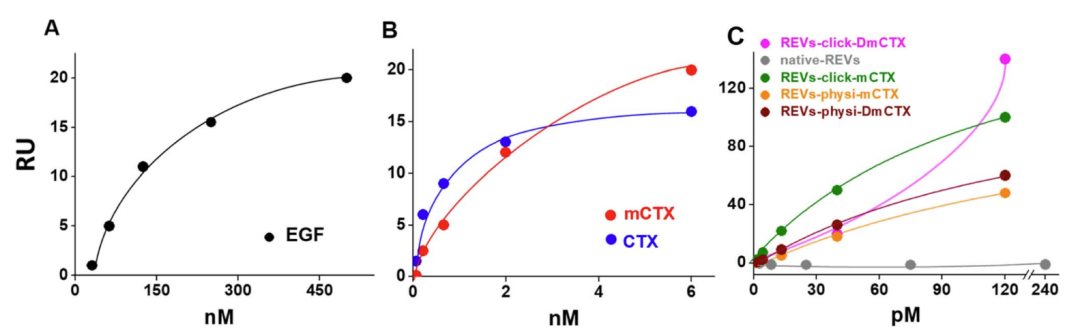
图4:Biacore X100检测EGFR与蛋白或REVs的亲和力
此外,作者还发现,同一张EGFR芯片检测中,REVs-click-mCTX的饱和结合信号Rmax比REVs-physi-mCTX高4倍,推测可能时由于物理吸附较弱,当mCTX与芯片表面的EGFR结合更强时,mCTX从REVs上脱落下来,牢牢地结合在芯片表面地EGFR上,并与REVs-physi-mCTX竞争性结合EGFR,最终导致芯片表面的最大结合量Rmax降低。而工程化的REVs-mCTX稳定性可能对体外囊泡摄取及其实际治疗应用具有重要意义,细胞实验发现REVs-click-mCTX对靶细胞表现出更好的结合和摄取能力。
03. 液体活检方法开发
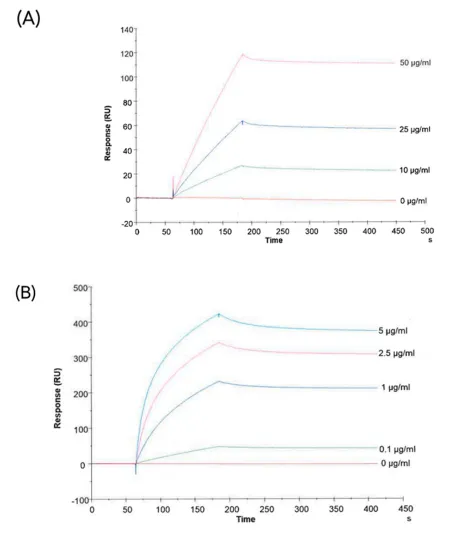
图5:Biacore检测anti-CA-IX抗体与CA-IX蛋白及sEVs的结合
外泌体等细胞外囊泡的功能研究,及其在在治疗、诊断领域的开发愈加火热,持续的技术和实验进展将会揭示更多其异质性和生物学功能的信息,促进其用于治疗和诊断疾病。Biacore作为高灵敏、高精准的分子互作技术,可以为各类型分子间的相互作用提供高质量的结合动力学、亲和力、浓度等数据,期待与广大用户共同发现更多新疗法,新应用。

 收藏
收藏 询价
询价