Biacore神助攻:GPCR活性调控机制研究取得突破性进展
G蛋白偶联受体 (GPCR)
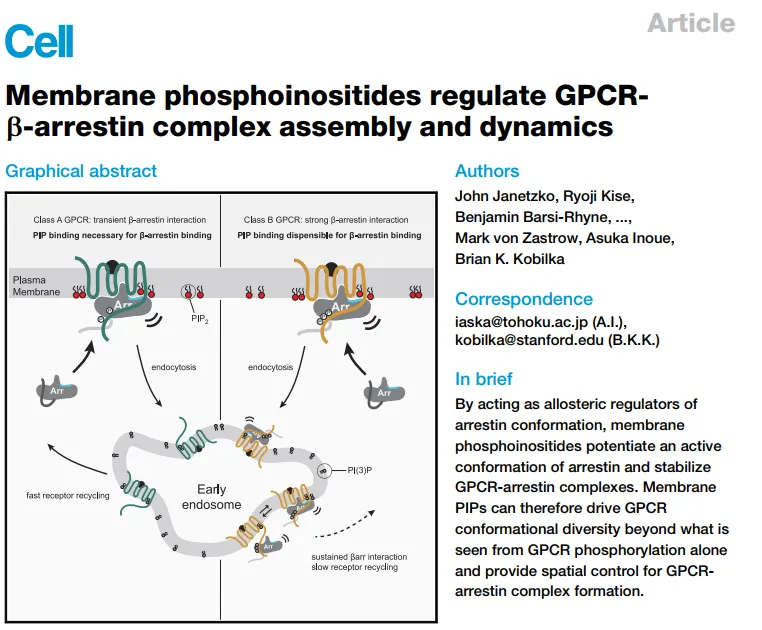
是目前已知的人类基因组中最大的膜蛋白家族,负责80%左右的跨膜信号转导,参与调控人体中多数病理与生理过程。在GPCR信号转导过程中,GPCR的激活和失活是最关键的事件之一,其中GPCR-β-arrerestin复合物的组装与稳定成为活性调控的“控制开关”。
但是这个“控制开关”到底是由哪个分子来控制?
整个活性控制机制又是如何运行?
这是几十年来悬而未决的问题。
由美国斯坦福大学主导的研究团队在Cell杂志上发表文章《Membrane phosphoinositides regulate GPCRb-arrestin complex assembly and dynamics》,成功破解了此问题,揭示膜磷酸肌醇 (PIP2) 调控β-arrestin的活性,并调控GPCR-β-arrestin复合体的稳定性以及动力学过程。
01. 此次研究的核心目标
- 确定PIP2的功能到底是什么?
- 它如何调控GPCR-β-arrerestin复合物的组装与稳定?
02. 研究思路
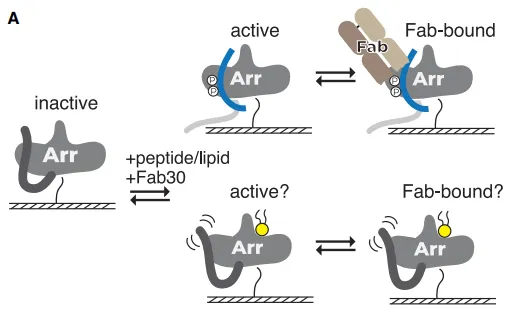
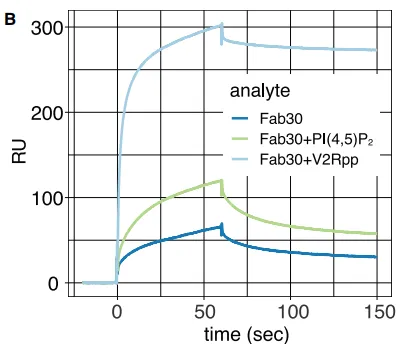
对于以上问题,研究人员设计出如下研究思路:使用Biacore SPR技术,首先将非活性态βarr1蛋白固定在SA芯片上,随后将Fab 30探针(专门与活性态的βarr1结合)与V2Rpp或PIP2的混合液流经芯片表面,看Fab 30探针的结合情况(图2)。
实验结果显示:
单独的Fab 30与处于非活性态βarr1蛋白的结合能力很弱;当V2Rpp存在时(非活性态βarr1转变为活性态)Fab 30与βarr1蛋白的结合能力非常强;当Fab 30与PIP2共注射时,Fab 30与处于非活性态βarr1蛋白的结合能力显著提升(图3)。此时,可以得出结论:PIP2具有正向调节βarr1蛋白活性态的功能。
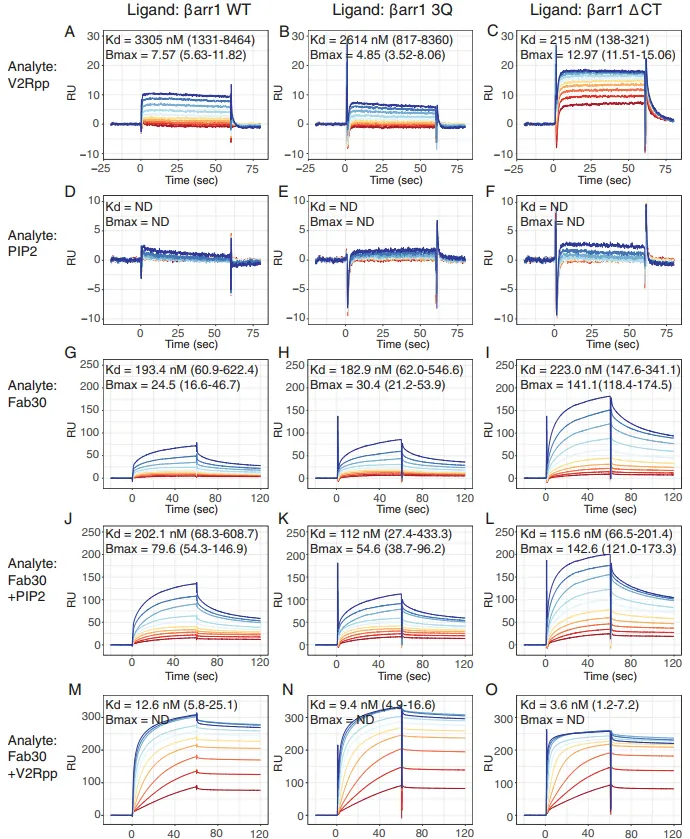
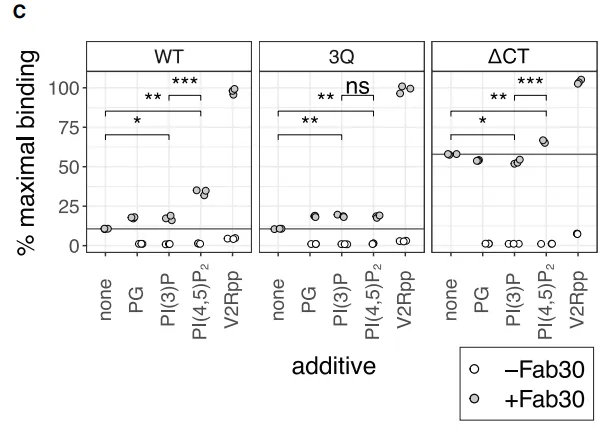
随后,研究人员再次使用Biacore SPR技术检测不同Analyte与βarr1蛋白野生型、3Q突变体、活性前体△CT突变体的结合能力并做数值统计(图4):
统计数据显示:
Fab 30与βarr1野生型最大结合能力约10%;活性前体△CT可达到约57%;40 mM PIP2与 Fab 30共注射时,最大结合能力相较于单独的Fab 30提升了3倍,且把活性前体△CT结合能力从57%提升到66%。此实验再次证明PIP2正向增加βarr1蛋白活性态的功能。此外,为了验证PIP2调节βarr1蛋白的特异性,使用Biacore SPR技术检测同类型阴离子脂质,实验观察到在βarr1野生型中PIP2显著性特异性(图5)。
最终,研究人员结合各类实验确定PIP2正向调控β-arrestin的活性状态,并且PIP2参与GPCR-β-arrestin复合体结合并促进其稳定存在,最终实现调节GPCR活性功能。此外,当不存在GPCR时,PIP2会诱发β-arrestin的构象变化,并增加β-arrestin激活形式的存在。

 收藏
收藏 询价
询价