二甲双胍靶点终破解,Biacore技术显神威
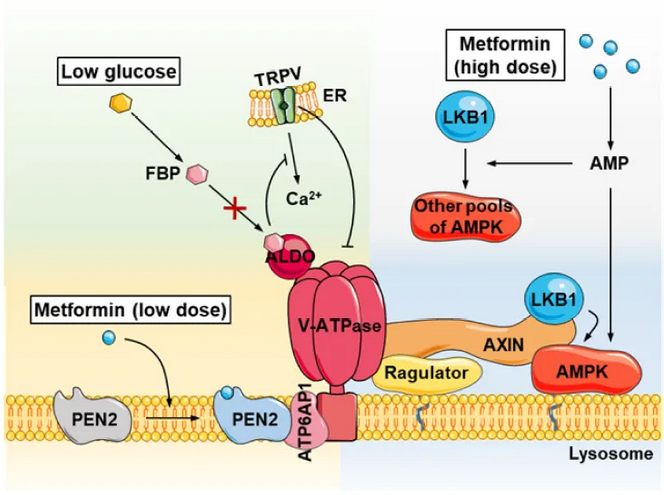
AMPK(AMP-activated protein kinase)是多种代谢途径的主要参与者。先前的研究发现,二甲双胍的疾病治疗作用至少部分与导致AMPK激活有关。然而,二甲双胍激活AMPK的机制目前尚不清楚,甚至是有争议的。2014年发表的一项研究表明,二甲双胍治疗增加了细胞内的AMP水平,但后来的一些研究在用二甲双胍处理的细胞系中并未检测到AMP水平的变化。
厦门大学生命科学学院林圣彩院士团队长期致力于代谢稳态和代谢疾病发生机制的研究,2016年10月11日,该团队在Cell Metabolism上发表了题为“Metformin Activates AMPK through the Lysosomal Pathway”的论文,揭开了二甲双胍降血糖作用背后的机制,并且找到了该药抗癌作用相关的新线索。2022年2月24日,林圣彩院士团队和厦门大学邓贤明教授团队合作,通过“钩钓”式的化学探针,找到了百年神药二甲双胍的分子靶点,即二甲双胍发挥其神奇作用的蛋白——PEN2(γ-secretase的亚基),并搞清了它工作的具体方式。这一历时七年的研究成果发表在国际顶级学术刊物Nature杂志上。
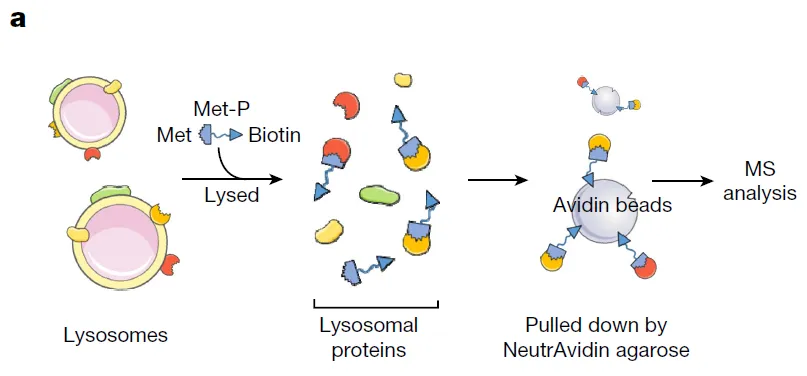
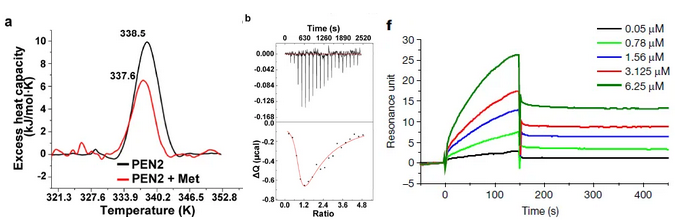
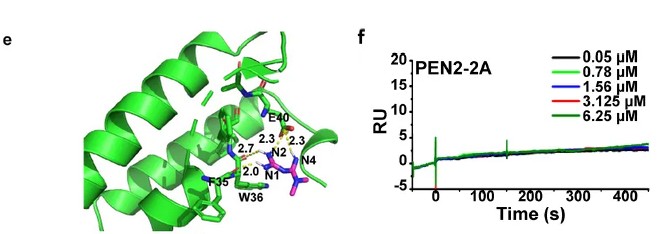
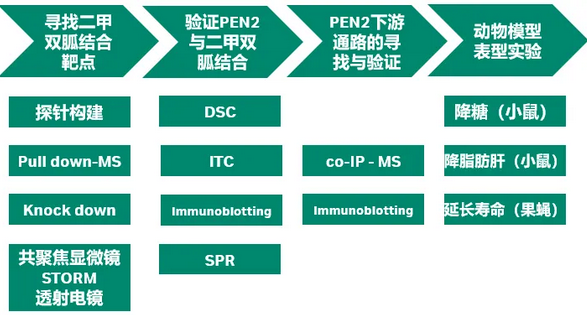
在该项研究中,邓贤明教授团队首先通过一系列摸索,突破了多个化学合成上的难题,合成了二甲双胍的化学探针(Met-P1)。将生物素标记的二甲双胍与溶酶体的裂解液孵育,使用NeutrAvidin beads进行pull down后进行质谱分析(图1)。从367个溶酶体上的蛋白中,鉴定出113个蛋白可以被Met-P1探针pull down。随后,研究者使用shRNA silencing逐一在细胞中knock down这些蛋白,最终找到了一个名为PEN2的蛋白,能够介导二甲双胍对AMPK的激活。共聚焦显微镜STORM,透射电镜数据也显示一部分(大约40%)的PEN2定位于溶酶体。
Biacore,
for a better life

 收藏
收藏 询价
询价