抗体药物研发新模式:AI + Biacore
新型冠状病毒自2019年底疫情爆发以来,在传播过程中不停的发生突变,尤其是像新冠这样的RNA病毒,更容易发生基因突变。全球范围内新冠病毒变异毒株已经发现超1000种,值得关注的新冠病毒变异株有五种:Alpha、Beta、Gamma、Delta和Omicron。这些突变株给新冠中和抗体的研发带来了巨大挑战。一些已经上市的抗体药物,对新冠突变株的中和活性明显降低 1。传统的抗体优化方法如定点突变、噬菌体展示技术,通量低、耗时长,无法快速获得针对不同新冠变体的高效中和抗体,急需一套高通量且智能的优化中和抗体的方法,提高现有新冠中和抗体的中和活性及广谱性。
近些年,人工智能(AI)药物研发风潮席卷,相较传统制药可以大幅减少研发投入及时间成本,提高新药研发效率和成功率,在不久的将来AI制药或将成为新药研发的主流方式。
近期,清华大学医学院张林琦教授团队、清华大学智能产业研究院和华深智药生物科技有限公司彭健教授团队以及MIT的Bonnie Berger院士团队合作在 PNAS《美国科学院院报》上发表了题为“Deep learning guided optimization of human antibody against SARS-CoV-2 variants with broad neutralization”的最新研究成果(图1),该研究构建了一个抗体优化的深度学习框架,并通过Biacore和假病毒中和实验验证,经过四轮的模型深入学习/预测以及实验验证,最终提高了现有新冠抗体的中和活性及广谱性,为抗体药物的研发提供了新的思路与方法——AI+Biacore。
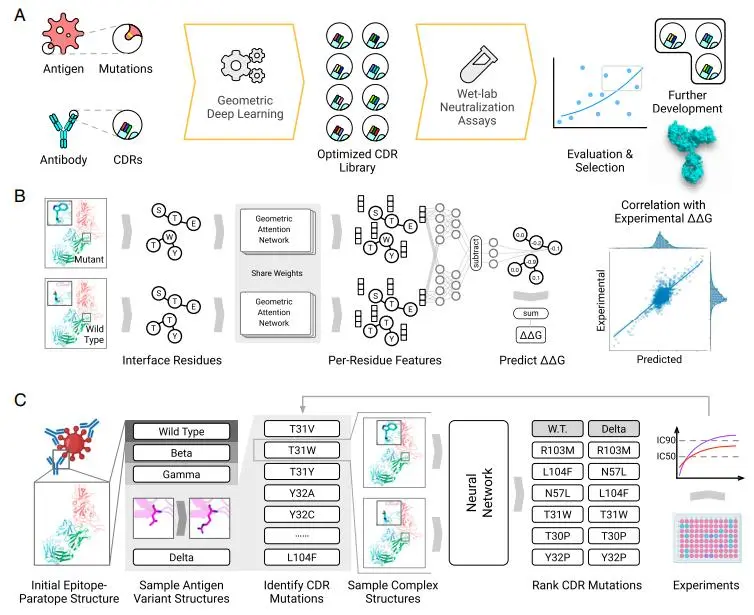
首先,科研人员基于大量抗体-抗原复合物结构及结合亲和力数据,开发了一种基于attention的几何神经网络架构,该模型可有效地提取残基间相互作用特征并预测由于抗体单个或多个氨基酸变化所引起的亲和力变化(图1)。他们选择了对新冠中和抗体P36-5D2进行优化,该抗体对新冠原始株、Alpha、Beta 和 Gamma 突变株具有较高的中和活性,但 Delta 突变株的中和活性较低。
第一轮,科研人员使用数据集中的复合物训练深度学习模型,输入抗体P36-5D2进行测试,模型输出自由能变化ΔΔG,将所有突变的结果进行排序,然后挑选出 12 个排名靠前的单突变,并将其引入到原始抗体 P36-5D2 中。利用假病毒中和实验进行确认发现,R103M突变极大提高了现有抗体对Delta突变株的中和能力,其他11个突变后的抗体,其中和能力略有提升或降低。
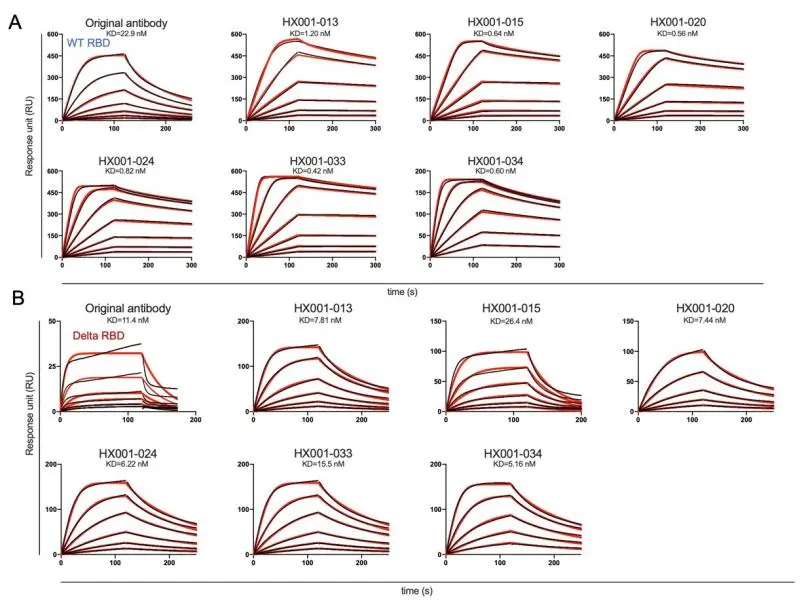
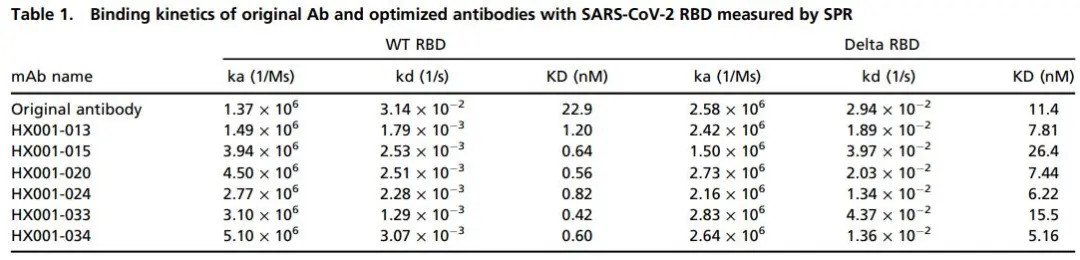
第三轮,基于第一、二轮实验结果,并根据模型ΔΔG 预测选择了15对三突变的抗体,通过中和实验确认,HX001-020 (R103M, T31W, L104F)、HX001-024 (R103M, N57L, L104F)和HX001-033 (R103M, T31W, N57L) 的中和能力较双突变又有了提升。进一步,使用Biacore检测,原始抗体/三个三突变抗体与WT RBD和Delta RBD的亲和力动力学,结果显示HX001-020、HX001-024、HX001-033与WT RBD的亲和力显著强于原始抗体,并且HX001-020和HX001-024与Delta RBD的亲和力同样强于原始抗体。
第四轮,根据第三轮的实验结果,他们将三个三突变抗体中的四个突变位点整合在一起,形成了四突变的抗体HX001-034(R103M, T31W, N57L, L104F),结果显示其中和能力略弱于三突变抗体。进一步,使用Biacore检测,原始抗体/四突变抗体与WT RBD和Delta RBD的亲和力动力学,结果显示HX001-034与WT RBD的亲和力显著强于原始抗体,并且与Delta RBD的亲和力同样强于原始抗体。
综上所述,该研究构建了一个基于深度学习的抗体优化方法,AI人工智能模型预测配合Biacore和假病毒中和实验,“干、湿实验”相结合,对原始抗体P36-5D2进行了高效的优化,每轮优化都可获得针对新冠突变株中和活性更广谱更有效的抗体。AI+Biacore的方法在极短的时间内即可完成一轮优化,这将使我们能够更快速高效地应对新冠突变设计出更好的抗体候选药物,这种高效的方法可以推广到几乎所有的药物研发中。Biacore作为中美日药典收录的互作检测技术,以其卓越的数据质量与极好的重复性,已然成为AI药物研发的黄金搭档,相信在“AI+Biacore”的双重加持下,未来药物研发会越来越快、越来越好!
目前,Cytiva推出了简化版的Biacore设备使用SOP,欢迎大家扫码打包下载,SOP在手,Biacore使用不愁!

 收藏
收藏 询价
询价