年度盘点:2022年Biacore助力在FDA获批的抗体药们
Biacore 作为药物活性检测综合平台,可以满足药物研发多个环节的需求,加快研发速度,其准确稳定的数据质量已经得到了药企和监管部门的广泛应用和认可。我们将从22年FDA获批的抗体药物中挑选一些具有代表性的药物来看看Biacore在其中发挥的重要作用。
首款治疗眼科疾病的双特异性疗法Vabysmo
基因泰克(Genentech)公司2022年1月28日宣布,美国食品药品监督管理局(FDA)已批准使用Vabysmo(faricimab-svoa)治疗湿性或新生血管性年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)。它是首款获FDA批准用于眼部的双特异性抗体。

faricimab设计基于150 kDa人IgG1的框架生成了双特异性CrossMAb RG7716,faricimab (RG7716)由两个不同的重链和两个不同的轻链组成。一个配体结合臂结合VEGF-A,另一个结合ANG-2。实验人员运用Biacore T200,将RG7716通过芯片表面上的抗Fc抗体捕获固定。如图1所示,在绿色传感线所代表的实验中,先注入了第一段ANG-2然后注入第二段VEGF-A,比较他们的结合趋势。红色传感线显示了相反进样样顺序的结合测试结果。两次实验结果均显示,其中任何一个抗原与faricimab (RG7716)的结合都不会影响该双抗与另一个抗原的结合。通过Biacore证明了faricimab (RG7716)能同时结合ANG-2和VEGF-A。
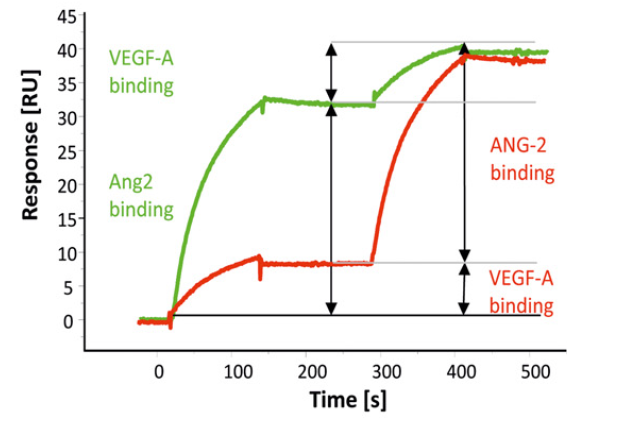
图1 Biacore检测双特异性抗体faricimab (RG7716)与Ang2/VEGF-A的结合
faricimab (RG7716)是一种全人源双特异性抗体,能够与VEGF-A的所有亚型结合,同时与ANG-2结合而不与ANG-1结合。科研人员通过Fc区域的工程优化 faricimab (RG7716)用于视网膜适应症,Fc区域被设计为消除与所有FcγR和FcRn的结合。为了证明RG7716与相应的人Fc受体的结合丧失,将FcγRIa,FcγRIIa,FcγRIIIa和FcRn蛋白固定在SPR传感芯片上,流经RG7716与对照抗体。Biacore实验结果显示,改造后的RG7716与FcγR和FcRn均不结合。改造后的抗体与野生型IgG1抗体相比可提高疗效,提升眼内持久性,保证快速系统清除。并且通过优化Fc区,减少全身暴露和潜在的促炎反应。
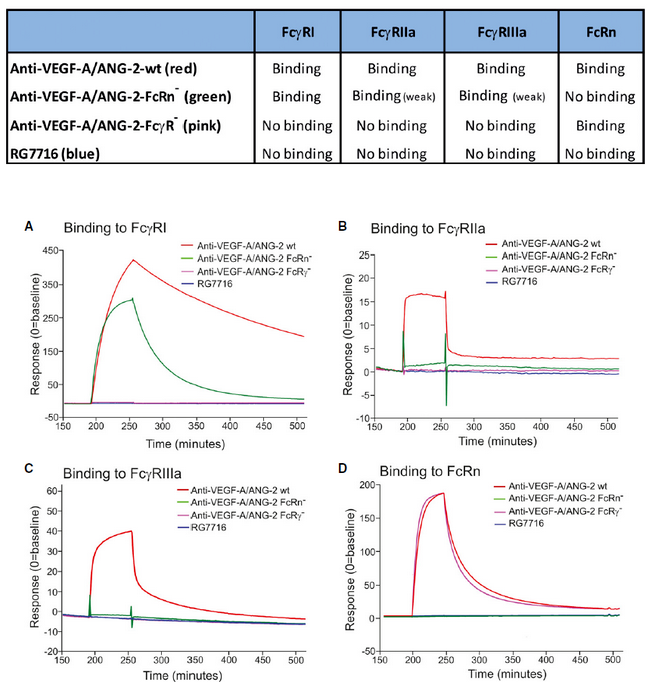
表1 RG7716与FcγR和FcRn的结合数据汇总表
首款获批的LAG-3抗体药物Opdualag
2022年3月18日, FDA首次批准了双重免疫治疗药物Relatlimab + Nivolumab(商品名: Opdualag)上市,作为一种LAG-3抗体药物,用于治疗罹患不可切除或转移性黑色素瘤的成人和儿童(12岁及以上)患者。Relatlimab(LAG-3抑制剂)是继PD-1 抑制剂与 CTLA-4抑制剂之后,百时美施贵宝旗下的第三款免疫检查点抑制剂。值得一提的是, Relatlimab是美国FDA批准的首款LAG-3抗体,也是近10年来针对全新免疫检查点获批的首款创新癌症免疫疗法。

在该药的研发与申报中,Biacore被用于评估Relatlimab与重组的人源和小鼠LAG-3蛋白细胞外结构域的结合。Relatlimab与人源LAG-3的结合亲和力为0.12nM,表明与LAG-3蛋白的结合亲和力强。(表2)。

表2 Biacore检测Relatlimab与LAG-3的亲和力数据
首个GPP银屑病药物Spevigo
2022年09月01日,勃林格殷格翰(Boehringer Ingelheim)宣布,美国FDA已批准选择性白细胞介素-36受体(IL-36R)抗体Spesolimab(商品名:Spevigo)上市,用于治疗泛发性脓疱性银屑病(GPP)的发作。Spesolimab是一种新型选择性抗体,可阻断白介素 36 受体 (IL-36R) 的激活,IL-36R 是免疫系统内的一种信号通路,已被证明与GPP的发病机制有关。
在该药的研发与申报中,研究人员检测了Spesolimab与IL36R结合亲和力,分别检测了Spesolimab和人类、小鼠、大鼠、仓鼠、迷你猪、恒河猴、狨猴和食蟹猴IL36R结合情况,发现Spesolimab与人类IL36R的结合亲和力为223 pM,与其他物种的结合亲和力非常低。在2019年的一项临床前研究,勃林格殷格翰利用SPR技术得到了候选药物MAB92和小鼠特异性抗体MAB04的亲和力数据(表3)。
表3 小鼠特异性抗体MAB04与小鼠和候选药物MAB92与人类的结合亲和力等数据
肝细胞癌首款双免联合方案获批
FDA于2022年10月21日批准STRIDE组合用于不可切除肝细胞癌(HCC)。在度伐利尤单抗的基础上添加单剂量tremelimumab治疗不可切除肝细胞癌这项适应症已在今年4月份被FDA许可优先审查。阿斯利康(AstraZeneca)的Imjudo(Tremelimumab)与Imfinzi(Durvalumab,度伐利尤单抗)组合疗法治疗肝癌中最常见的不可切除性的肝细胞癌(HCC),此为在免疫疗法的领域里的重大突破。Imjudo(Tremelimumab)是一种靶向CTLA-4的单克隆抗体,藉由阻断CTLA-4的活性,促进T细胞活化,启动肿瘤免疫反应,促进癌细胞死亡。 Imfinzi(Durvalumab) 则为人源抗PD-L1抗体药物。
在申报材料中, Tremelimumab使用Biacore进行药物与靶点CTLA-4的之间的亲和力检测,与重组人源CTLA-4的亲和力为0.28nM,重组鼠源为0.98nM。

表4 Tremelimumab与靶点CTLA-4的亲和力检测数据
研究人员在研究的过程中也检测了与不同物种与其相对的靶点(CTLA-4与PD-L1)的结合亲和力。Durvalumab与重组人源PD-L1亲和力为831pM 。Tremelimumab与重组人源CTLA-4的亲和力为2.14 ± 0.97 nM,而同为靶向CTLA-4的单抗药物ipilimumab则为4.42 ± 1.01 nM。
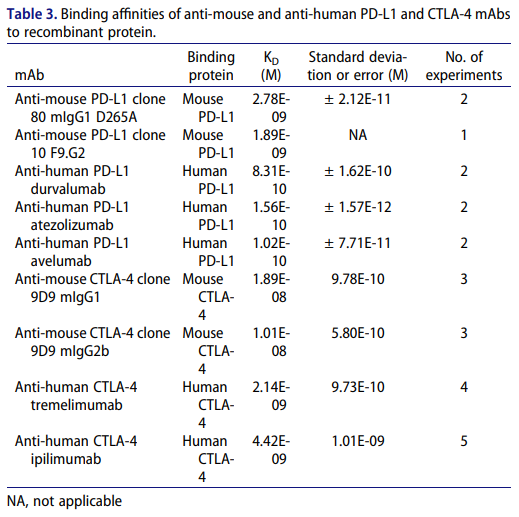
表5 Durvalumab与PD-L1及CTLA-4的亲和力检测数据
这些生物活性值反映了抗体的相对效力,保持了与基于细胞的结合EC50相似的趋势,表明抗体与细胞上的目标的结合效力与它们随后的生物功能呈正相关。
全球首款BCMA/CD3双抗Teclistamab
2022年10月25日,强生(Johnson & Johnson)集团旗下杨森(Janssen)公司宣布,美国FDA已经加速批准同时靶向B细胞成熟抗原(BCMA)和CD3受体的双特异性抗体Tecvayli(Teclistamab)上市,用于治疗复发/难治性多发性骨髓瘤(RRMM)成人患者。
Teclistamab-cqyv是靶向B细胞成熟抗原(BCMA)的CD3双特异性T细胞衔接剂,能够靶向结合T细胞表面表达的CD3受体以及多发性骨髓瘤细胞和BCMA。通过将CD3阳性T细胞募集到表达BCMA的骨髓瘤细胞附近,启动T细胞杀伤癌细胞的双特异性抗体疗法。值得一提的是Teclistamab是第一个获批治疗多发性骨髓瘤的双特异性疗法,也是第一个获批靶向BCMA的双特异性抗体。
在其申报的文件中,Teclistamab使用Biacore检测药物与不同物种靶点BCMA之间的亲和力,与人源的BCMA抗原的结合亲和力为0.18nM,比起食蟹猴的BCMA抗原亲和力高约36倍(6.5nM) ,小鼠的亲和力则低很多(72.6nM) 。

图3. Teclistamab申报数据截图
抗体药物是基于基因工程和细胞工程技术制备的药物,具有性能均一、靶点定向制备、特异性高的优势,在肿瘤、免疫系统等各类疾病的治疗中发挥着重要的作用。根据统计目前85%已经上市的抗体药物,在它的研发和生产中都使用到了Biacore。
2020版中国药典将表面等离子体共振技术收入免疫化学法部分。其推荐Biacore用于以下四个领域的检测。
免疫原性测定
结合活性测定
分子间亲和力测定
复杂样品中特定蛋白质浓度的测定
目前,Biacore 基于表面等离子共振技术已经被中国、美国和日本药典收录。Biacore 技术符合GxP 和21 CFR Part 11 法规的要求,其准确稳定的数据质量已经得到了药企和监管机构的广泛应用和认可,为企业加快抗体药物上市保驾护航。

 收藏
收藏 询价
询价