ADC药物研发与上市申报用什么,当然还是Biacore!
面对威胁人类健康的恶性肿瘤、癌症,经典的放化疗法或手术切除往往会给患者带来极大的生理痛苦且治疗效果并不持久。抗体偶联药物(Antibody-drug conjugates,ADCs)是一类重要的靶向治疗癌症患者的生物药,是由拥有强细胞毒性的化疗药物通过连接物与单抗偶联形成,兼具小分子药物强大的杀伤力和纯单抗高度的靶向性,因而成为肿瘤靶向治疗的研究和发展热点。
目前已获EMA或FDA批准上市的ADC药物共有12种(见表1),无疑昭示着ADC行业已随着技术不断成熟而迅速扩张,有研究机构预测ADC药物市场将有望超过500亿美元。例如2021年4月23日获批上市的Zynlonta分子,可特异性靶向CD19分子从而发挥抗弥漫性大B细胞淋巴瘤(DLBCL)的功能。
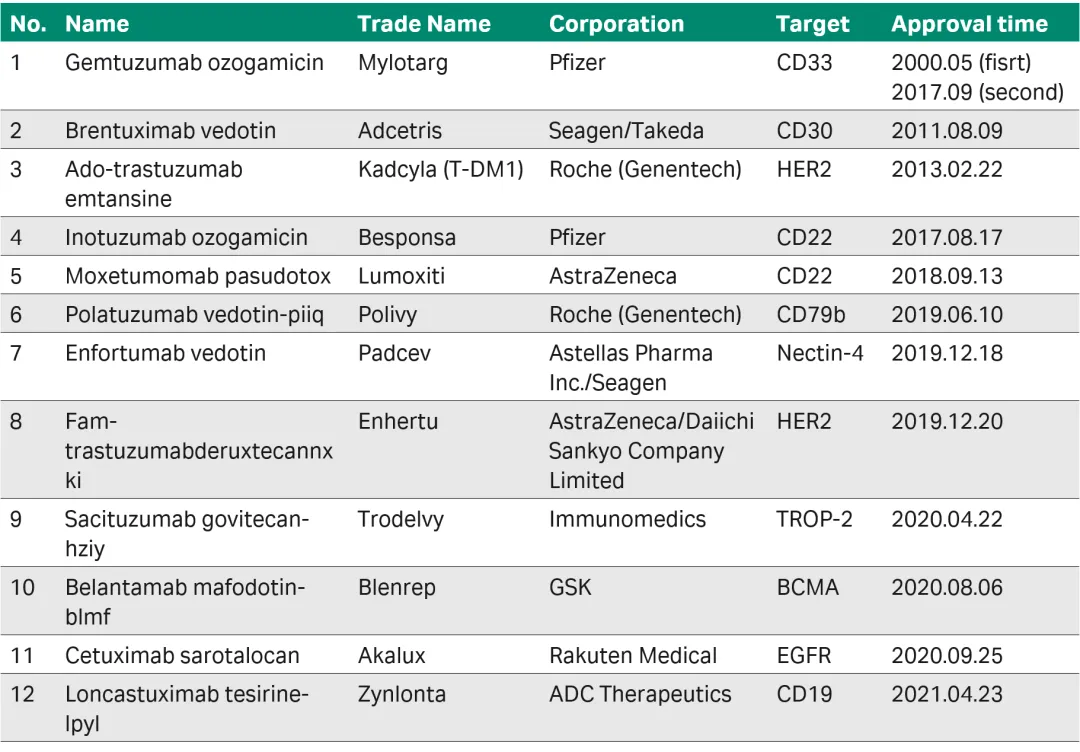
表1 已获批上市的ADC药物总结(来源于网络)
ADC一般通过稳定的接头(Linker)将单克隆抗体和细胞毒性药物有机结合,此技术手段可同时增强单抗对靶抗原的特异性识别力与细胞毒药物的高效性。其实,这些不同抗体、Linker、偶联方式的选择,以及每个抗体上偶联多少个毒素分子即药物-抗体结合比(Drug-Antibody Ratio,DAR)等都有可能影响到ADC与靶分子的结合。
其中,抗体骨架分子一般需要同时具备特异性识别靶点、亲和力高、半衰期长等特点,才能有望成为细胞毒药物运输载体。理想的抗体需要与靶分子具有较高亲和力,一般KD为pM~nM级。这就要求在ADC 的设计与开发过程中,需要选择具有灵敏度高、特异性好、亲和力检测范围宽和卓越数据质量的技术对ADC的理化性质进行全面的检测与分析。
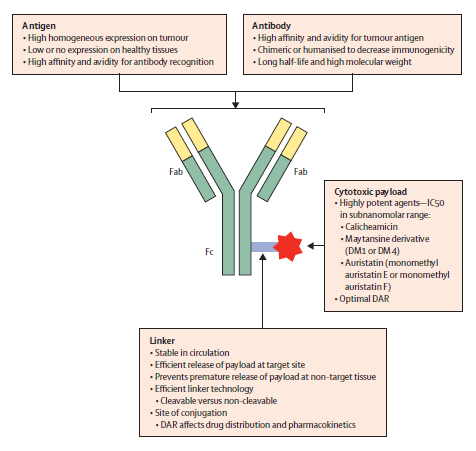
图1 ADC结构示意图[1]
作为唯一被中国、美国和日本药典收录的分子互作检测“金标准”,以Biacore为代表的SPR技术已广泛应用到ADC药物的研发、生产与上市申报。在抗体的早期筛选、Linker/DAR的优化、抗体与药物偶联前后与靶点结合亲和力的一致性评价、生产质控与批次放行、血液中ADC活性浓度监测等环节发挥了巨大作用。下面小编就为大家详细介绍Biacore在这些环节中的应用情况。
ADC与靶点的结合活性检测及一致性评价

图2 Besponsa专利文件截图内容
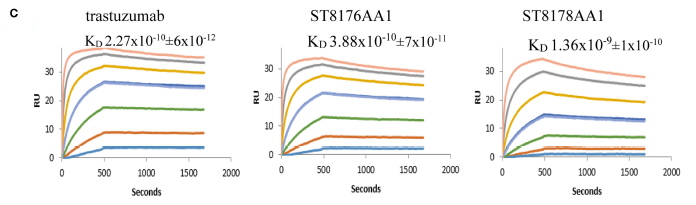
图3 Trastuzumab, ST8176AA1, ST8178AA1与HER2 receptor的动力学表征[2]
2020年6月,意大利BIOVIIIx公司在杂志《International Journal of Biological Marcromolecules》上发表相关研究内容,围绕只含有Fab组分的ADC分子展开功能性研究。实验结果如表2所示,相较对照抗体分子Trastuzumab,其它ADC分子与靶蛋白的亲和力都发生了一定程度改变,亲和力水平的细微差异对筛选出最具开发潜力的ADC分子提供了重要理论依据。相较于ELISA等传统检测方法,Biacore具有极高的分辨率,能够准确表征亲和力相近分子的细微差别,从而助力不同ADC分子的精确筛选。
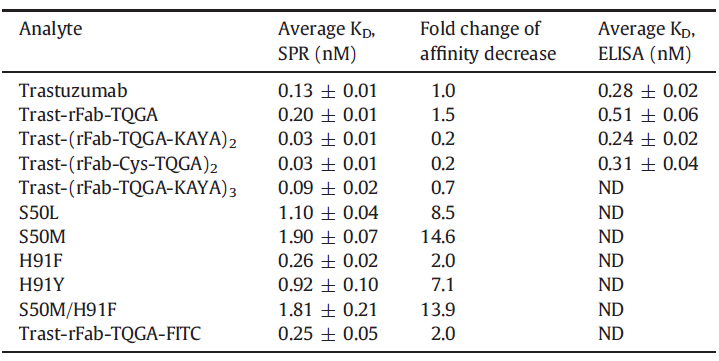
表2 不同组分的ADC分子与His-HER2(靶蛋白)的亲和力检测[3]
不同Linker设计对ADC与靶点结合活性的影响评价
在ADC的设计与开发过程中,可以选择不同的Linker将抗体与毒素分子偶联在一起。Linker的种类、链的长短有很多种设计,有些Linker通过被酶解或酸解,可以从抗体上剪切下来,而有些则完全不能剪切。通过不同的Linker将抗体与毒素分子偶联,可能会影响抗体与靶点的结合。通过Biacore 检测抗体偶联不同Linker后与靶点结合的亲和力与动力学数据,则可以精确判定这些不同的Linker对ADC与靶点结合活性的影响。
英国斯旺西大学的研究人员在开发针对卵巢癌靶点的新型ADC药物的过程中,使用Biacore检测了不同Linker对ADC与靶点(REF1)结合活性的影响。他们开发出了两个能够与卵巢癌靶点(晚期糖基化终末产物受体,RAGE)特异结合的抗体,并通过两种不同的Linker(可剪切/不可剪切),分别将两个抗体与特定的毒素分子偶联在一起。
在这个过程中,他们利用Biacore比较了抗体在偶联了不同的Linker后与抗原的结合活性变化。观察Kon/Koff图(图4)不难看出,RBGO1-ADC相较RBGO1裸抗,无论是哪一种Linker,RBGO1-ADC与相应抗原RAGE结合的动力学与亲和力均未发生明显变化。而带有不同Linker的RBGO3-ADC与相应裸抗相比,其与抗原RAGE的结合速率明显降低。相较ELISA等传统检测方法,Biacore不仅能得到亲和力的数据,还能够对不同抗体的结合及解离速率进行表征,这一结果为筛选优质的ADC药物提供了重要的实验数据。
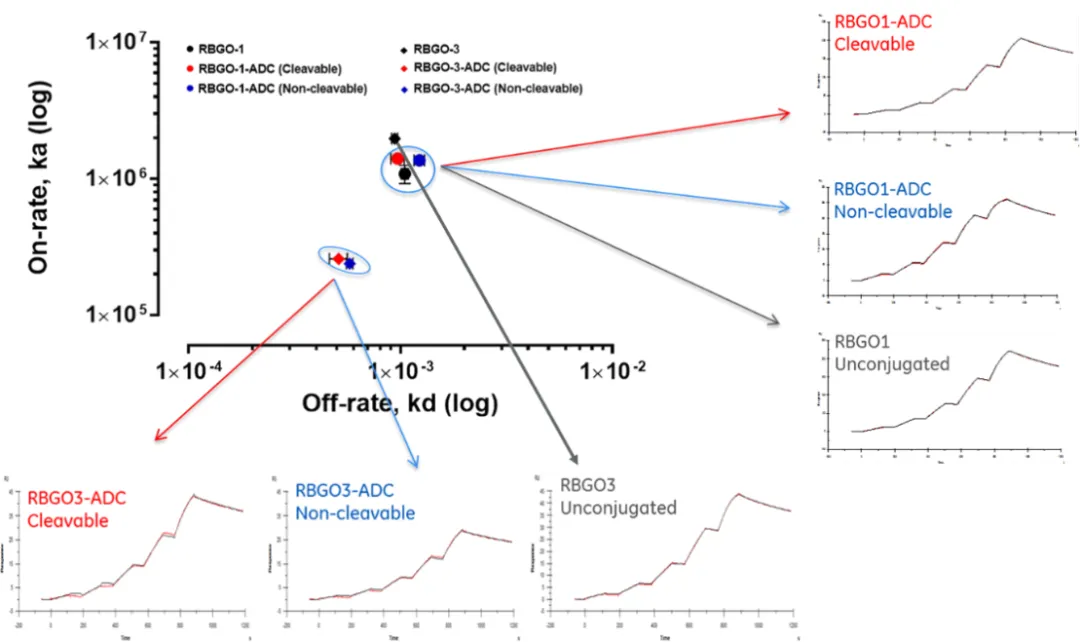
图4 不同Linker对RBGO1-ADC、RBGO3-ADC与抗原结合活性的影响[4]
DAR对ADC与靶点结合活性的影响评价
来自英国斯旺西大学的研究人员在研发抗卵巢癌的ADC药物时,同样利用Biacore 检测了不同DAR对ADC与抗原REF1结合活性的影响。如图5所示,他们的研究结果表明,DAR分别为1.5和3.5的ADC与相应的裸抗相比,它们与抗原结合的亲和力并未发生明显变化。说明这些不同数量的DAR并不影响ADC与抗原的结合。
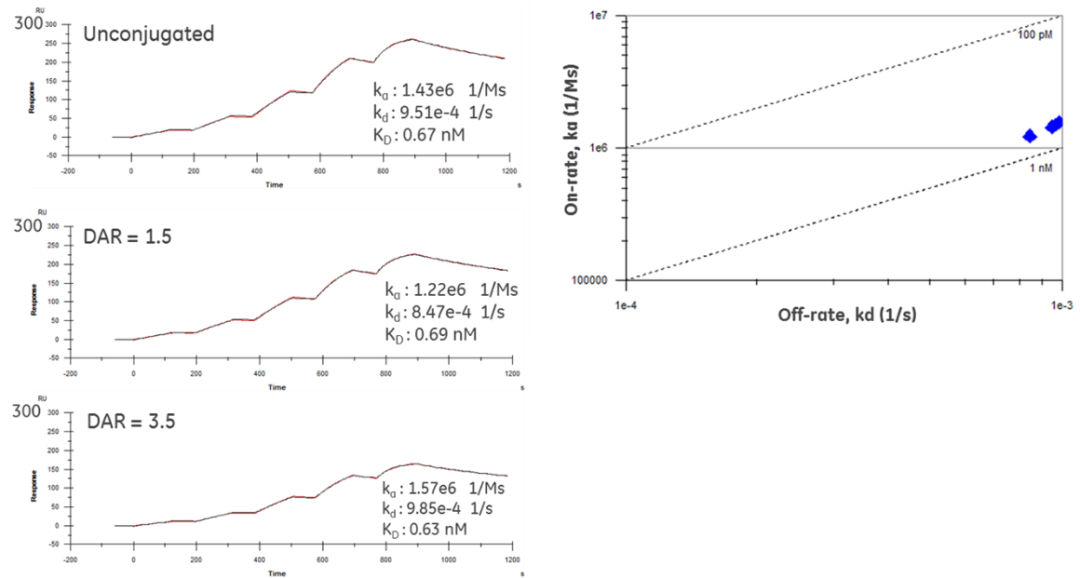
图5 不同DAR对RBGO1-ADC、RBGO3-ADC与靶点结合活性的影响[4]
生产质控:ADC的批次放行
研究人员使用CM5芯片与抗人Fc抗体自制捕获芯片,“抓取”不同批次的T-DM1或参照品,采用单循环动力学方法测定其与HER2的亲和力。如图6所示:测定T-DM1 参比品、样品和裸抗的结合常数,发现两者之间的结合常数非常接近。样品经重复检测3次,测定的KD平均值为1.03±0.02 nM,RSD 也控制在5%以内。除了亲和力数值水平上的精确表征之外,Biacore所特有的指纹图谱比对功能,能精确、直观的呈现ADC与相应裸抗之间,以及不同批次的ADC产品之间的细微差异,并给出差异系数,从而精确定量不同批次产品的稳定性。
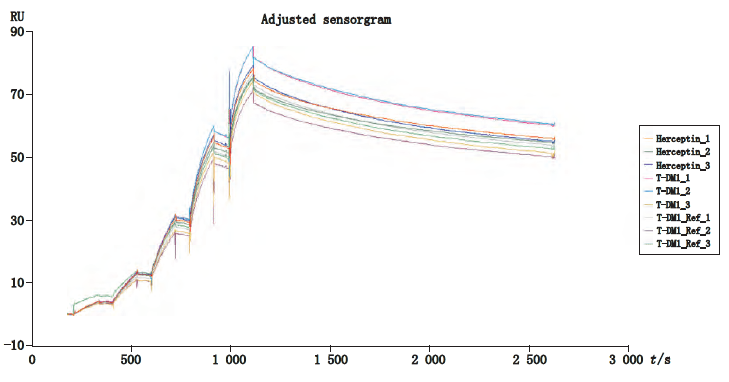
图6 中检院单抗室借助Biacore开发ADC的质控方法[5]
临床研究:ADC的活性浓度检测
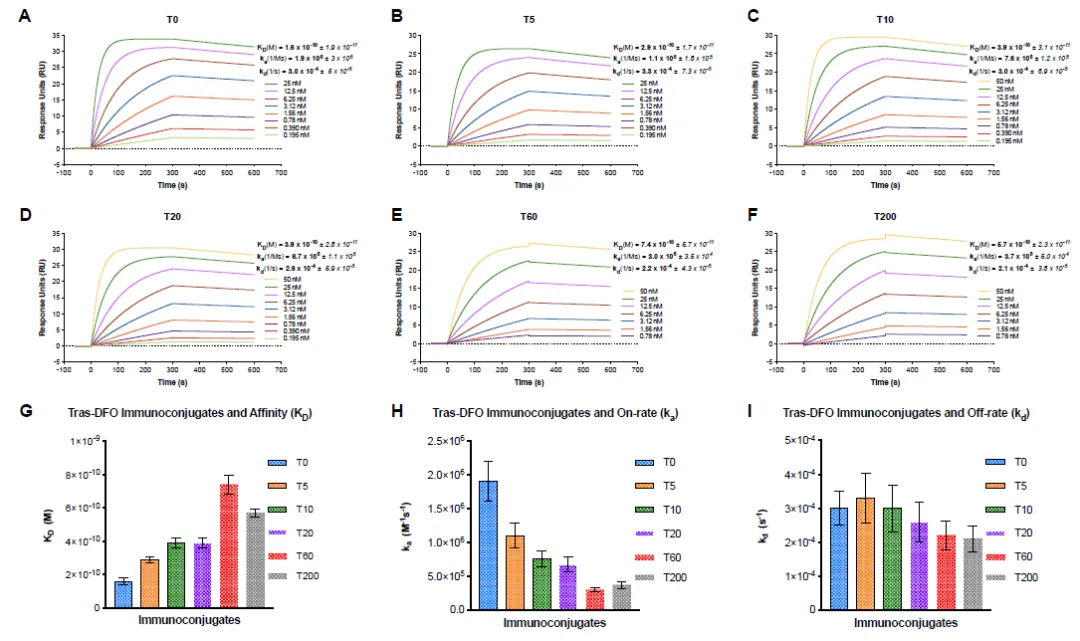
图7 不同ADC分子与靶分子的动力学表征数据:原始图谱(上、中)与拟合结果(下)[6]T0: 未经修饰的抗体分子;
T5 – T20: 偶联了不同药物的ADC分子
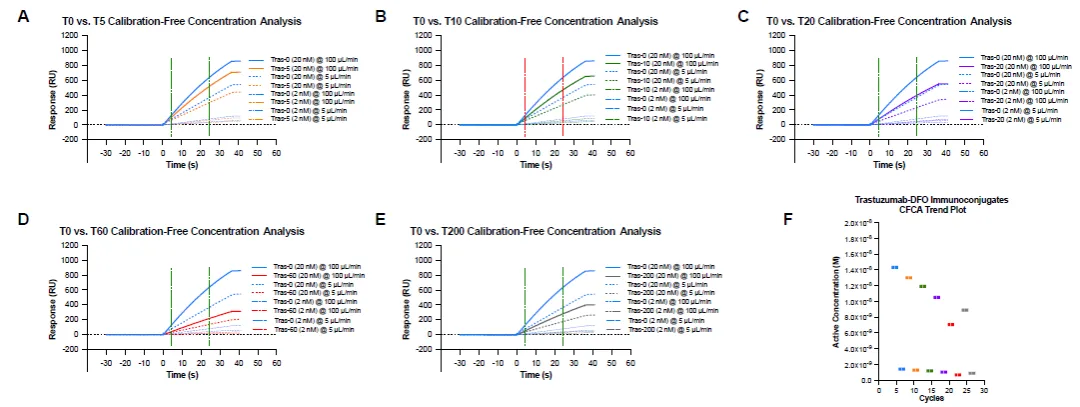
图8 CFCA法测定血液中不同ADC分子的浓度 [6]
近十年来,通过对各个实验细节的改进与认识的深入,ADC已经发展成为一种成熟的生物制药类别。随着ADC研究的迅猛发展,相信未来基于亲和力进行结构优化设计的ADC分子会越来越多出现在临床研究中!
自1990年上市以来,Biacore作为唯一被中美日药典收录的分子互作检测“金标准”,已广泛应用到基础科研与药物开发的多个领域。截至目前,借助Biacore累计发表的文章已突破55,000篇,超过80%的已上市抗体药物的研发、申报、生产过程中均使用了Biacore。相信有了Biacore的助力,未来一定会有越来越多的ADC药物从研发走向上市。

 收藏
收藏 询价
询价