群雄逐鹿,GLP-1RA赛道到底谁是最终赢家?
图1 Tirzepatide FDA批准文件
回溯糖尿病治疗药物的发展史,自1922年胰岛素首次成功应用于糖尿病治疗以来,糖尿病药物仍在不停研发升级。当今市场上有多种降糖药可供选择,如双胍类、胰岛素类、GLP-1受体激动剂(GLP-1RA)等等,其中GLP- 1RA是近年来新型降糖药物的主战场。
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种主要由肠道L细胞所产生的内源性激素。GLP-1通过激活GLP-1受体(GLP-1R),可以促进胰岛素的分泌,抑制胰高糖素分泌,并能够延缓胃排空,通过中枢性的食欲抑制减少进食量,从而达到降低血糖,减肥等作用。但天然GLP-1的半衰期非常短,各类可以发挥类似作用的降糖药GLP-1RA逐渐在市场出现。纵观GLP-1RA的研发历史,Biacore在药物筛选、长效化、免疫原性的研究中都发挥了核心作用,下面就详细盘点一下Biacore的精彩表现吧。
01. Biacore推动Lilly划时代的GIP/GLP-1R双靶点激动剂的设计
对于包括GIPR和GLP-1R在内的B类G蛋白偶联受体(GPCRs)而言,N端ECD是一种独特的结构特征,与配体识别机制有关。研究人员使用Biacore T200,将两个受体GIPR及GLP-1R的胞外域固定于芯片表面,将原始设计Tirzepatide(TZP),去除C20的TirzepatideΔC20(TZP ΔC20),GLP-1类似物(Ex-4)以及GIP,作为分析物流经芯片表面,快速获得亲和力/动力学检测数据。
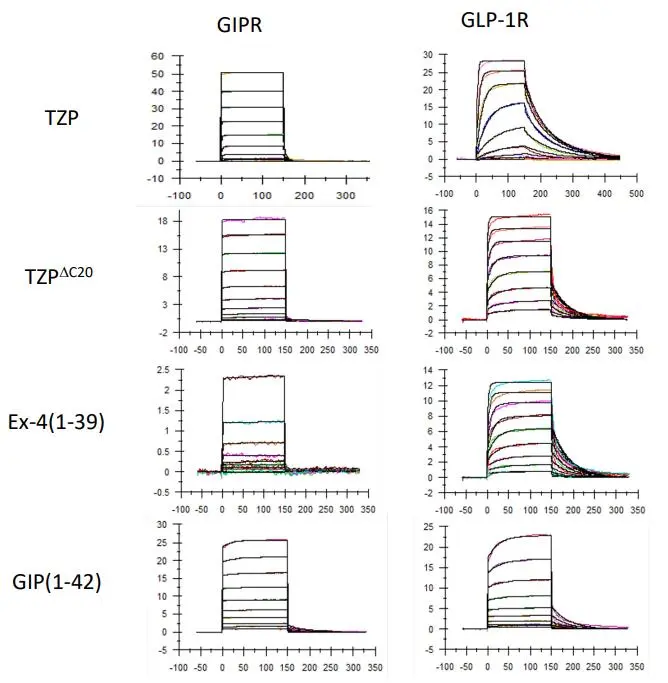

实验结果表明,Tirzepatide与GIPR的结合在µM级别, Tirzepatide亲和力KD= 4.2 μM , TirzepatideΔC20亲和力KD = 1.7 μM,证明不含脂肪酸链的Tirzepatide ΔC20,与GIPR的结合更强。针对GLP-1R的检测均具有更高的亲和力,Tirzepatide亲和力KD= 23 nM, TirzepatideΔC20 亲和力KD= 111 nM,证明增加了脂肪酸链后(Tirzepatide)的亲和力提高。GLP-1类似物(Ex-4)与GLP-1R受体的亲和力在10-8级别,而GIP与GIPR的亲和力在10-5级别,这说明两个受体对于天然激动剂的亲和力本来就存在差异。综合评估后,选择了加上脂肪酸链的设计方案,可以维持更高的GLP-1RA亲和力的同时,牺牲部分GIP亲和力,与天然激动剂与受体的亲和力保持一致,并且大大提升了其半衰期。
Biacore助力Tirzepatide在分子层面确定与两个受体的结合情况,最终促生了这一代全新的双靶点GLP-1RA的横空出世!
02. Biacore助力长效化GLP-1RA设计与筛选
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)具有半衰期短的问题,给药后由于酶的水解作用或肾小球的滤过损失,使得药物体内存留时间较短。为了应对GLP-1类似物半衰期短的问题,通常的做法是将其融合到一个大的蛋白,例如白蛋白、Fc或者能和白蛋白结合的结构域上,以延长其在体内的存留时间。首当其冲的是诺和诺德在2010年上市的一款具有里程碑意义的GLP-1RA——利拉鲁肽(Liraglutide),利用脂肪酸链结合白蛋白的GLP-1形式,有效延长药物的半衰期,可以实现每周一次给药。
研究人员一直在不断尝试不同类型的长效化方案。暨南大学在RSC Advances发表的一篇文章,“Design and evaluation of novel thrombin-based GLP-1 analogs with peptidic albumin binding domain for the controlled release of GLP-1”揭示了一种通过不同脂肪链长度的七肽标签结合至白蛋白的GLP-1RA优化设计方案,文章中采用Biacore筛选获得了可高亲和地结合于白蛋白的全新GLP-1类似物PES14,有效延长体内的半衰期。
研究表明七肽标签与人血清白蛋白(HSA)具有很好的亲和力,研究团队使用一个由柔性连接子(GGGGS)2和凝血酶(TBN)可切割位点(FNPR)组成的中间序列,将一系列具有不同脂肪链长度的七肽标签融合到突变的GLP-1的N端,设计并制备了21个融合肽,命名为PESO1-PES21(图2)。
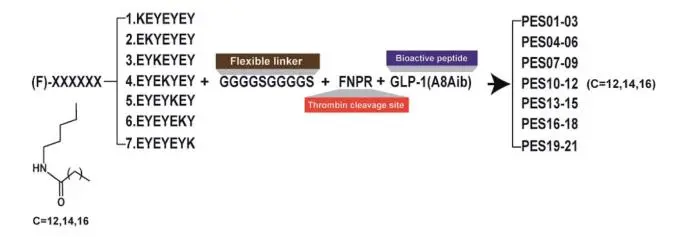
图2 七肽融合GLP-1设计示意图
随后,使用Biacore进行了融合肽与HSA的亲和力筛选,从结果中可以看到(表2),在二十多个融合肽中,PES13, PES14,和PES15 与HSA具有较强的亲和力(PES13,3.83×10-7 M;PES14,6.96×10-7 M;PES15,5.12 10-7 M)。更为重要的是,由于Biacore不仅可以获得亲和力数据,还可以同时获得解离速率常数kd,通过关注这三组样品的kd,发现亲和力强的原因是因为具有较慢的解离速率,说明其与HSA的结合稳定性较强,这也是我们进行长效化设计的主要目的。后续针对这三例药物,进行血浆稳定性实验及动物实验,确定了基于此设计的PES14在保证药物有效性的同时,极大地提升了药物的半衰期。
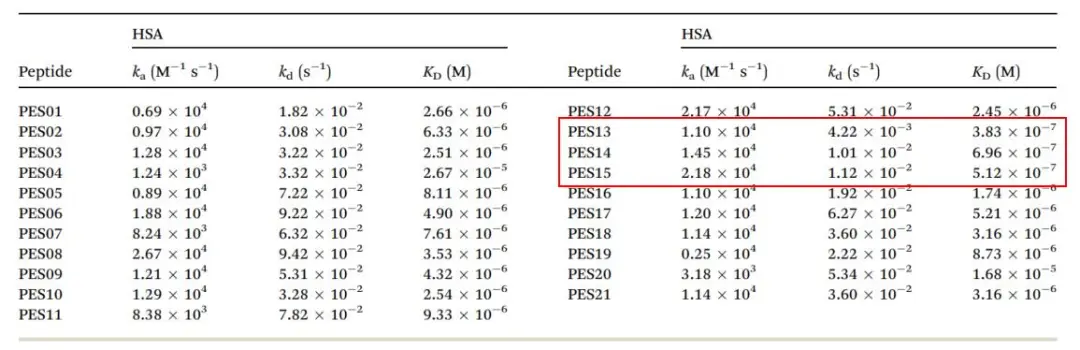
表2 融合肽与HSA的亲和力/动力学筛选
在长效化策略的更新迭代中,我们见证了GSK的阿必鲁肽(Albiglutide),Lilly的度拉糖肽(Dulaglutide),诺和诺德的司美格鲁肽(Semaglutide)的诞生。今后GLP-1RA的赛道上,长效化设计仍会是经久不衰的议题,而Biacore必将在长效化设计上持续助力。
03. Biacore助力多种GLP-1RA免疫原性检测

图3. 赛诺菲-利西那肽(左)和诺和诺德-司美格鲁肽(右)基于Biacore进行免疫原性检测
无论是诺和诺德还是礼来,无论是国外还是国内,GLP-1RA赛道的这场战役终究没有结束。诺和诺德的多靶点GLP-1RA正虎视眈眈;现在大多剂型均为注射用药,口服小分子GIP-1RA研发也已在途。作为唯一被中国、美国、日本药典收录的分子互作检测技术,Biacore已经广泛应用到GLP-1RA多肽药物的各开发环节。Biacore 作为分子互作检测金标准,也可以广泛用于抗体、疫苗、多肽、小分子药物的研发、机理研究、免疫原性、质控放行等各环节,将继续为新药开发护航助力。无论谁能称霸这一片市场,Biacore都希望可以继续见证GLP-1RA的迭代升级!
1.Niu X, Nong S, Zhang X, et al. Design and evaluation of novel thrombin-based GLP-1 analogs with peptidic albumin binding domain for the controlled release of GLP-1. RSC Adv. 2020;10(8):4725-4732. Published 2020 Jan 29. doi:10.1039/d0ra00104j
2.Sun B, Willard FS, Feng D, et al. Structural determinants of dual incretin receptor agonism by Tirzepatide. Proc Natl Acad Sci U S A. 2022;119(13):e2116506119. doi:10.1073/pnas.2116506119
3.Marbury TC, Flint A, Jacobsen JB, Derving Karsbøl J, Lasseter K. Pharmacokinetics and Tolerability of a Single Dose of Semaglutide, a Human Glucagon-Like Peptide-1 Analog, in Subjects With and Without Renal Impairment. Clin Pharmacokinet. 2017;56(11):1381-1390. doi:10.1007/s40262-017-0528-2

 收藏
收藏 询价
询价