Biacore双标智测,疫苗安全更高效
在疫苗生产过程中,病毒血凝素 (HA) 和宿主细胞蛋白 (HCP) 的准确量化对于确保疫苗的安全性和有效性至关重要。这两者的精准定量不仅可以控制疫苗质量,还可能进一步改善疫苗的免疫原性。
流感疫苗的效力与HA浓度相关,现有定量HA最常见的通过单径向免疫扩散法 (SRID) 来实现,另外,还可以通过酶联免疫吸附分析 (ELISA) 、神经氨酸酶 (NA) 活性分析、HPLC法、血凝分析法以及qPCR等方法实现。但是以上方法,存在精度和灵敏度较低、费时费力、速度慢及需要分析前制备样品等缺点。 而宿主细胞蛋白 (HCP) 的定量检测直接关系到疫苗的纯度和安全性。通常,有两种主要的方法用于定量检测HCP:Bradford蛋白测定法和酶联免疫吸附测定法 (ELISA) 。 Bradford蛋白测定法:该方法基于染料与蛋白质结合的化学方法来测量总蛋白含量。然而,这种方法有其局限性:首先,其灵敏度较低,而且其检测范围也不够广泛,不能特异性地检测低于监管关键限制水平的HCP。 ELISA方法:这种方法使用针对细胞蛋白的多克隆抗体混合物来特异性地检测HCP。通过纯化的多克隆抗体,ELISA方法的灵敏度和特异性都有所提高。但是,其缺点也很明显,检测工作繁琐而耗时。
相比上述传统方法,使用Biacore技术来进行检测,可以显著改进HA和HCP的定量,通过直接测量分子间的相互作用来实现高灵敏度、高特异性和快速分析。Biacore检测不仅可以在短时间内提供准确的结果,而且能够检测到极低水平的HCP,从而确保疫苗的纯度和安全性。
01
Biacore流感病毒定量检测
Biacore通过抑制实验来定量流感病毒,原理如图所示,首先,HA被固定在CM5芯片上,以红色圆圈表示。随后,病毒与固定浓度的血清混合并进样结合。在平衡状态下未与病毒结合的游离抗体与HA结合,产生响应。当样本中病毒浓度较低时 (A) ,抗体结合量高;而病毒浓度较高时 (B) ,结合水平则较低。
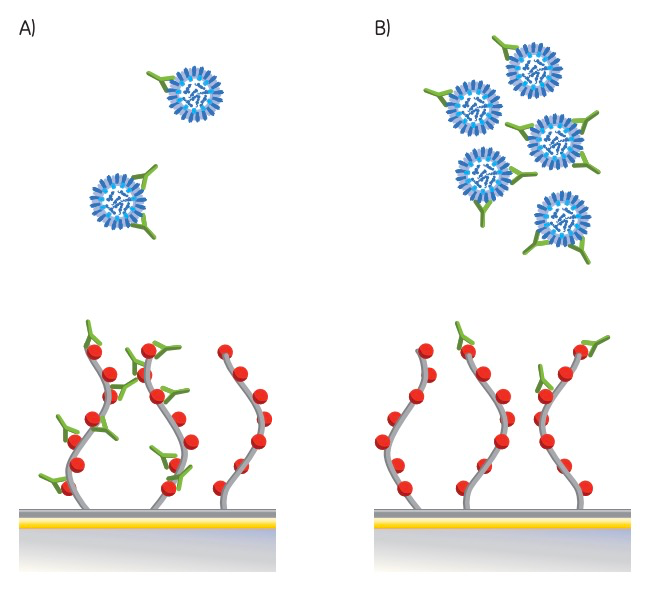
图1:Biacore流感病毒定量检测原理,A与B图分别表示病毒的浓度高低不同情况
1
抗原固定:首先,通过氨基偶联,将重组HA抗原固定在CM5芯片上,响应值范围设置在4000到10000之间。
2
标准曲线:梯度稀释免疫过的羊血清标准品(含有针对特定流感菌株的抗体),设置进样400 s,该稀释倍数需要大约结合1000 RU的信号。在这样的稀释倍数下,标准曲线的动态范围会达到0.5-8 µg病毒/mL。在检测的开始、中间和结束各运行了三条校准曲线。
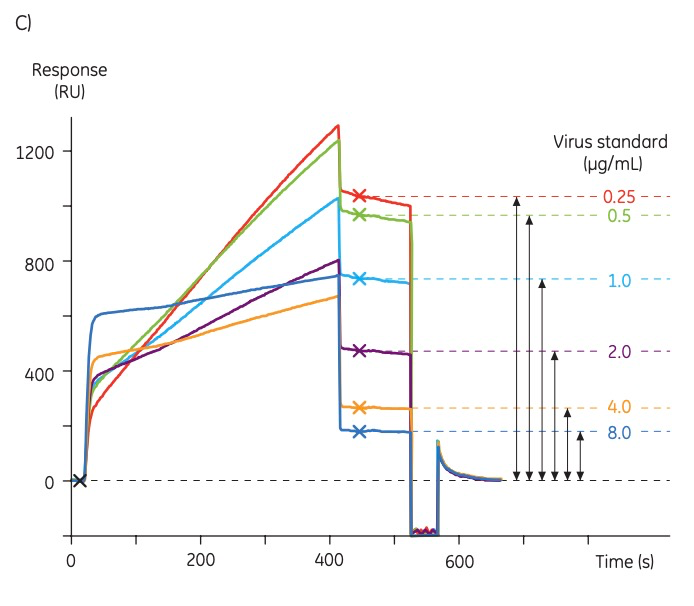
图2:Biacore流感病毒定量标准曲线传感图
3
样品分析:混合未知浓度的病毒样本与固定稀释度的抗流感血清,进样400 s。再生使用新鲜制备的50 mM HCl和0.05% Surfactant P20,时间设置为30 s。
针对流感病毒定量实验开发时,Biacore方法也与SRID方法进行了对比。样品来自流感疫苗纯化过程中不同步骤的样本,包括从细胞培养上清液到最终过滤产品。为了进行比较,还使用SRID(单径向免疫扩散法)对相同样本进行了分析,从对比数据可以评估它们的准确性、一致性以及重复性。
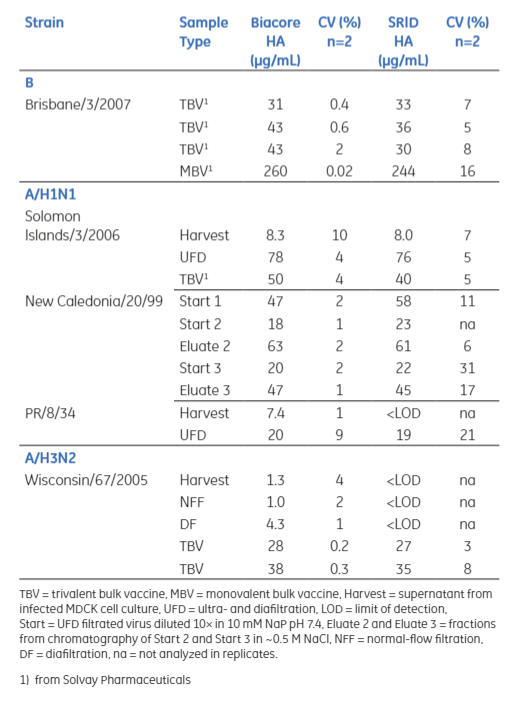
表1:Biacore定量检测和SRID定量检测的结果

表2:比较Biacore定量检测和SRID定量检测
通过实验结果对比,Biacore检测具有更低的CV值(表1),说明其检测准确性高,重复性好,而且Biacore方法操作时间更短,灵敏度更高,其仅为定量限 (LOQ) 为1 μg/mL(表2)。由于Biacore可以在单个实验中同时测定三种病毒株,因此也提高了分析效率。这充分说明了,Biacore可以应用于精准定量检测HA。
02
Biacore定量检测HCP的实验方法
1
抗体固定:抗HCP抗体通过氨基偶联的方式固定在CM5芯片上。
2
使用MDCK细胞裂解液(可生产HCP抗体)建立标准曲线(图4),为了提高HCP检测的精确度,在检测的开始、中间和结束各运行了三条校准曲线。
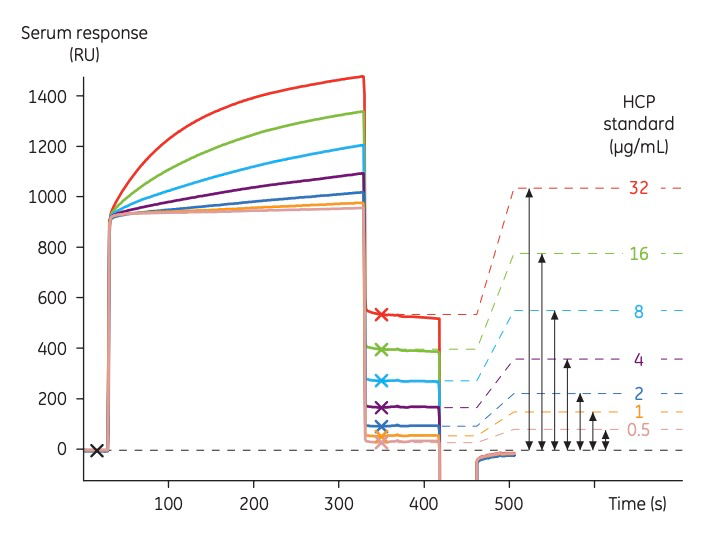
图4:Biacore定量检测HCP的标准曲线传感图
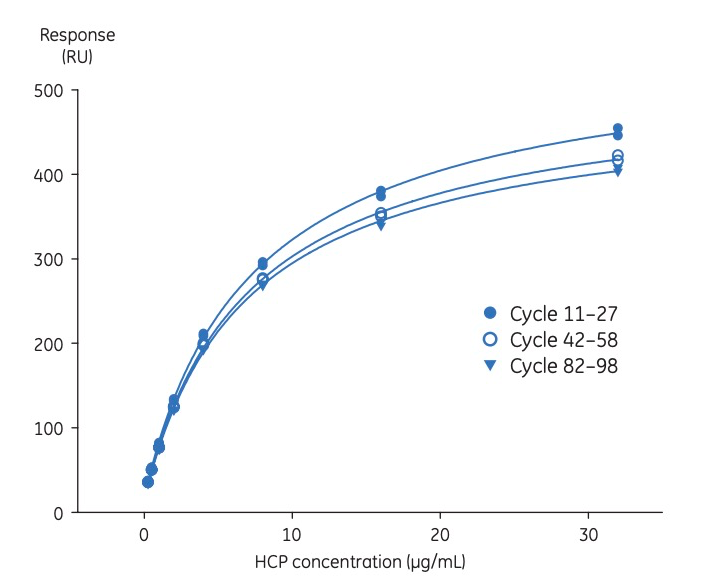
图5:Biacore定量检测HCP的标准曲线,其浓度范围为0.25至32 µg/mL
3
样本进样:将待检测的工艺样本进样至HCP抗体固定的表面上,此时,样本中的特定HCP蛋白会与表面的抗体结合,从而产生结合响应值(如图5所示)。
对于工艺样本,通过Bradford蛋白检测法分析的样本显示的蛋白质浓度值通常比使用Biacore定量HCP检测法分析得到的值要高。这是因为Bradford方法检测的是样本中的总蛋白质含量,这包括病毒蛋白以及其他非HCP的蛋白质。然而,Biacore通过特异性结合,定量检测HCP浓度,具有较好的特异性。Bradford的定量限为60 µg/mL,而Biacore定量限 (LOQ) 为0.3 µg/mL(表3),Biacore检测法显示出了比Bradford蛋白检测法高100倍以上的灵敏度。有了这样的定量限,在工艺开发过程中可以量化更广泛范围的样本。
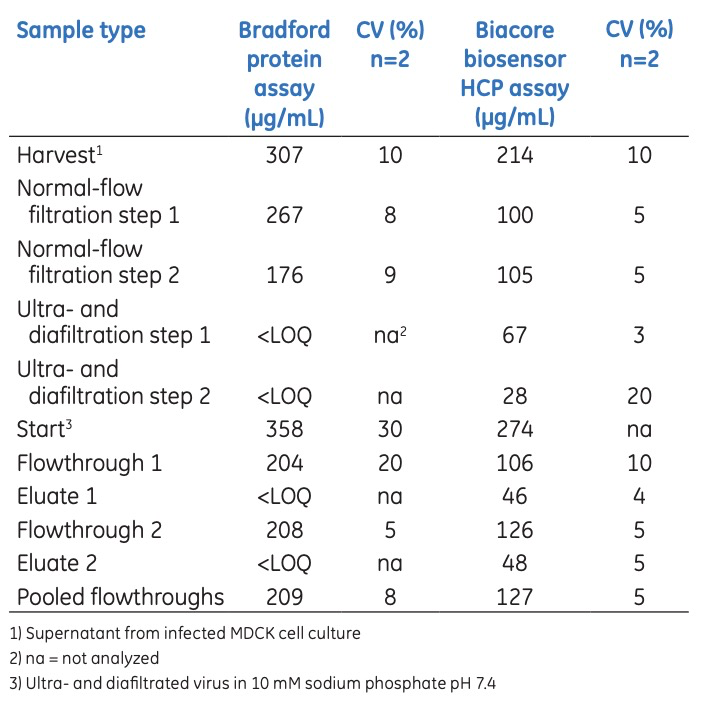
表3:Bradford蛋白检测法和Biacore定量HCP检测法的对比
总 结

 收藏
收藏 询价
询价