Biacore技术“拆解”MCL-1/BAK:靶向抗癌药物设计新突破!
其中,抗凋亡蛋白MCL-1通过结合并抑制促凋亡蛋白BAK的寡聚化,成为肿瘤细胞逃逸凋亡的关键分子。然而,MCL-1与BAK相互作用的分子细节尚不完全明确,限制了靶向该通路的高效抗癌药物开发。
中南大学湘雅医院肿瘤科及暨南大学的研究人员在《Acta Neuropathologica Communications》中发表文章,利用Biacore技术,系统解析了MCL-1与BAK结合的分子特异性,揭示了p5疏水亚口袋在相互作用中的核心作用,为设计新型MCL-1抑制剂提供了关键理论依据。

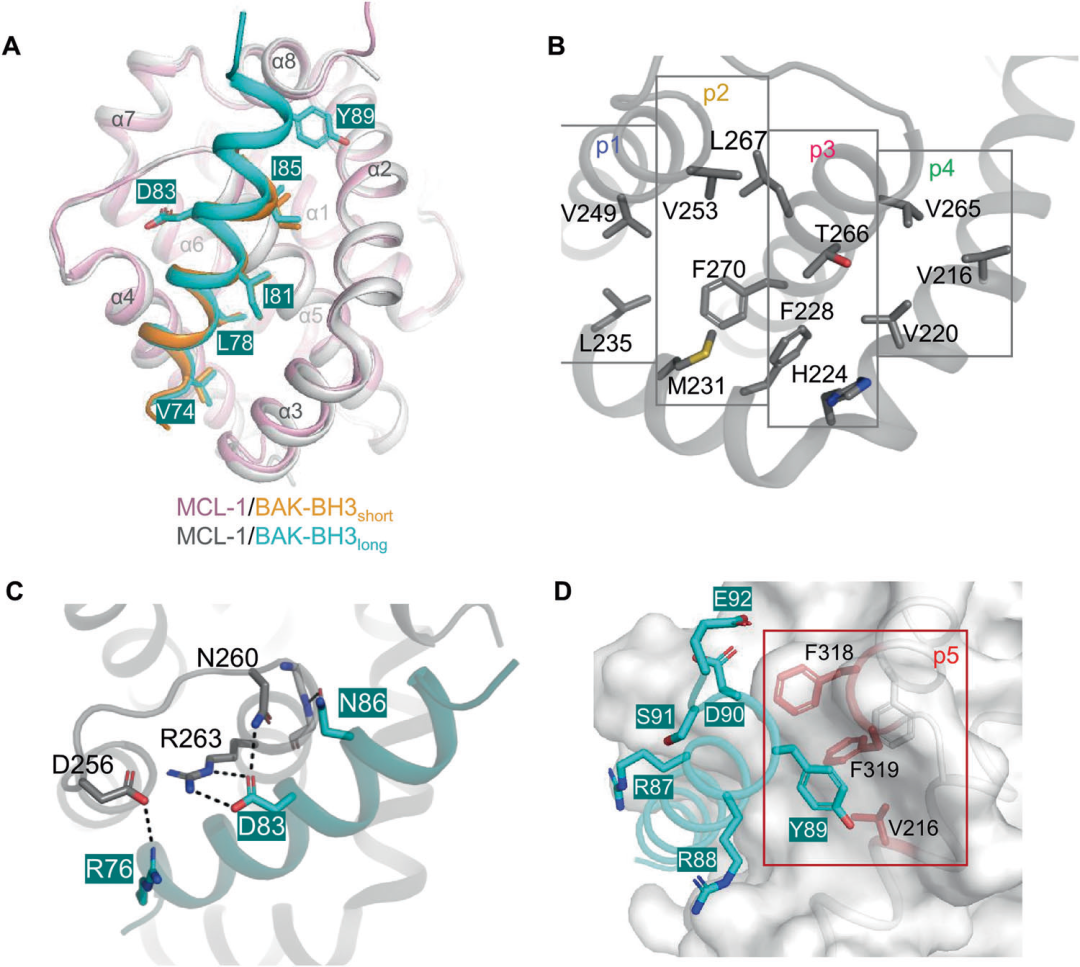
通过X射线晶体学解析复合物结构(分辨率1.98 Å),发现BAK多肽呈现α螺旋构象,其疏水残基Val74、Leu78、Ile81和Ile85精准嵌入MCL-1的BH3结合沟槽(图2A、B),带电荷残基Asp83 BAK与Arg263 MCL-1之间形成了保守的盐桥相互作用(图2C)。与BAK-BH3short多肽相比,BAK-BH3long多肽的延伸残基额外形成一个α螺旋转角(α-helical turn),且h4残基(Ile85)位置发生微小位移(图2A)。
在延伸的五个残基中,Arg88 BAK、Asp90 BAK、Ser91BAK和Glu92 BAK与MCL-1之间基本不存在范德华相互作用(图2D)。然而,Tyr89 BAK与MCL-1的疏水平面区域(由Val216、Phe318和Phe319等疏水残基构成)形成显著的疏水相互作用(图2D)。
综上,MCL-1通过p5亚口袋特异性识别BAK C端延伸序列(尤其Tyr89),相比之下,BCL-XL则依赖经典BH3沟槽结合,对C端序列无偏好,这也为设计靶向MCL-1/BAK的高选择性抑制剂提供理论依据。
科学发现最终需回归细胞验证
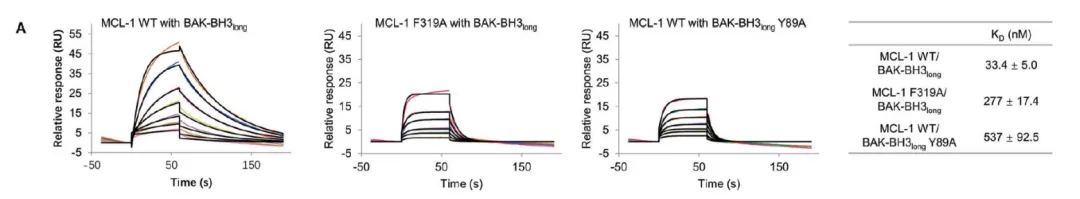
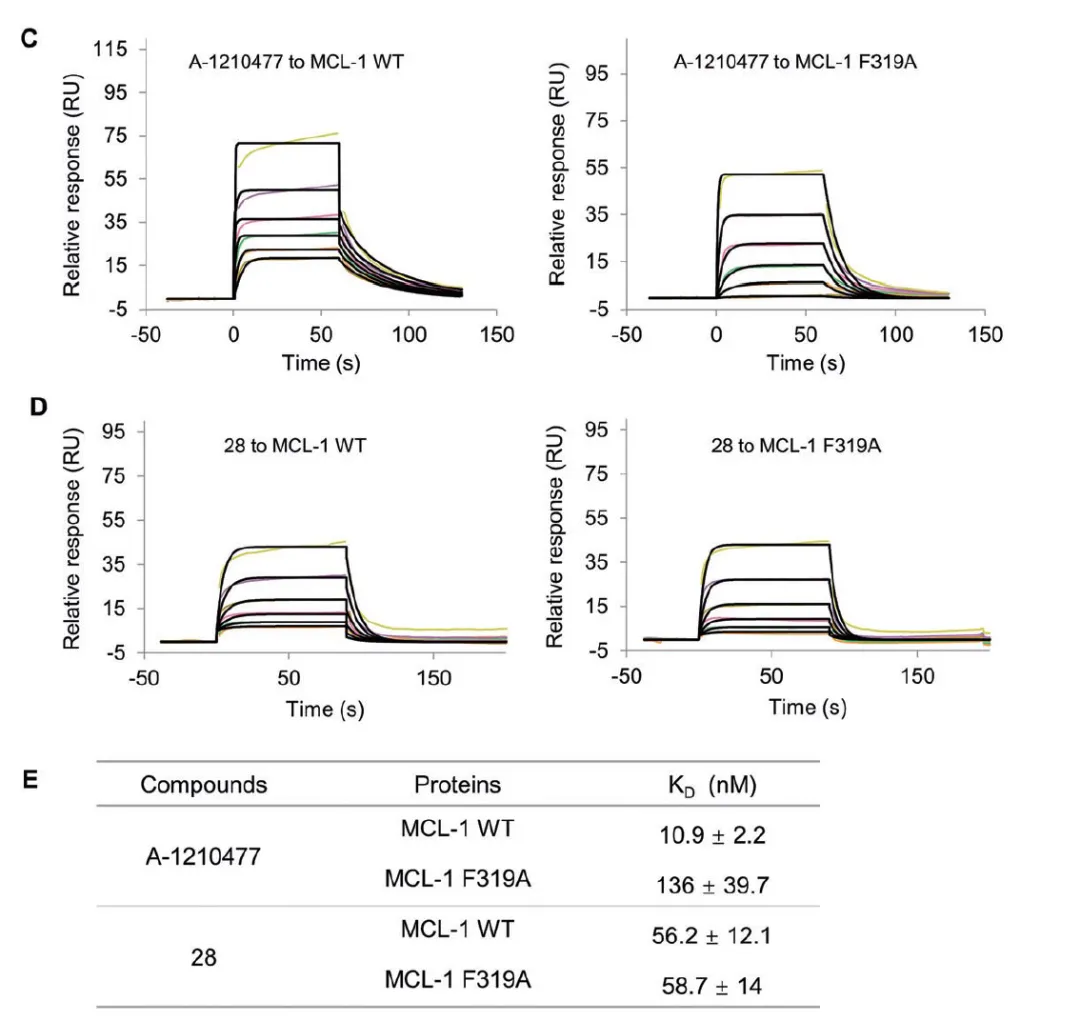
这一发现颠覆了传统认知——MCL-1不仅依赖保守的p2-p4亚口袋,还通过独特的p5亚口袋实现BAK特异性识别。基于这一发现,研究人员测试了p5亚口袋对A-1210477及其先导化合物28的潜在作用(A-1210477是首个具有高亲和力和选择性的MCL-1选择性BH3模拟物)。
结果发现,A-1210477对MCL-1的亲和力约为其先导化合物28的5倍,而MCL-1突变体F319 A对A-1210477的亲和力降低约一个数量级,而其对短链先导化合物28的结合几乎未受影响。结合竞争荧光偏振(FP)实验和共晶实验结果,研究人员得出了这个结论:A-1210477的延伸磺酰胺基团与MCL-1 p5亚口袋的紧密结合可显著提升抑制剂活性。这一发现为设计靶向p5亚口袋的高效MCL-1抑制剂提供了新策略。
目前,癌症治疗已进入“精准时代”,而靶向MCL-1/BAK相互作用正是这一时代的典型代表之一。随着结构生物学与药物设计的不断进步,我们有理由相信,针对这一“生死开关”的精准治疗将早日造福患者,为癌症治疗带来新突破。
期待这一突破性发现能够推动肿瘤等重大疾病的精准治疗发展,通过持续深化对凋亡通路的理解,加速靶向药物的临床转化,最终为患者带来更安全有效的治疗选择。
获取更多SOP文件


 收藏
收藏 询价
询价