Easy Biacore系列8 | 遵守药典要求,做好Fc受体检测
Fragment crystallizable receptor (FcR)是表达于细胞膜表面并能与抗体Fc结构域结合的受体。与不同的免疫球蛋白结合的受体统称为FcRs,它参与调节和执行抗体介导的免疫反应。一般而言,FcRs连接特定的适应性免疫系统和先天性免疫细胞(肥大细胞、中性粒细胞、单核细胞和巨噬细胞)触发的效应区,进而引发诸多免疫效应,例如:补体依赖的细胞毒效应 (CDC);抗体依赖的细胞吞噬作用 (ADCP);抗体依赖细胞介导的细胞毒效应 (ADCC) (图1)。
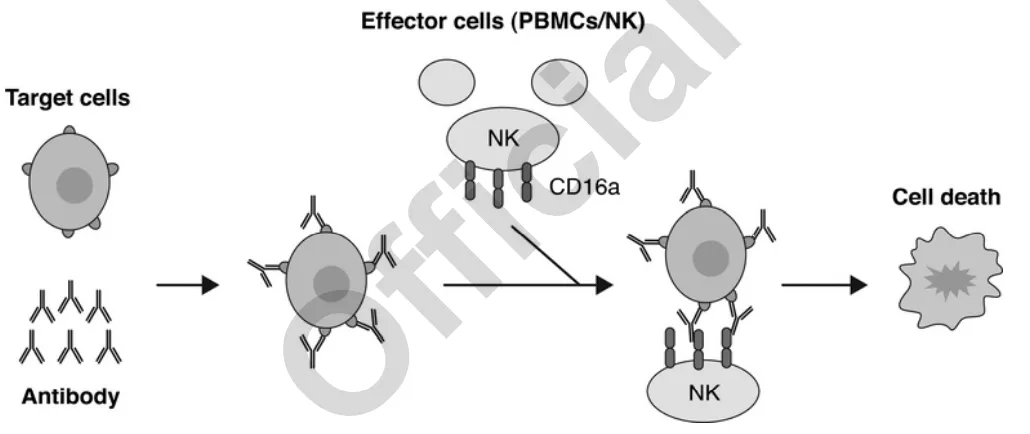
图1 ADCC效应
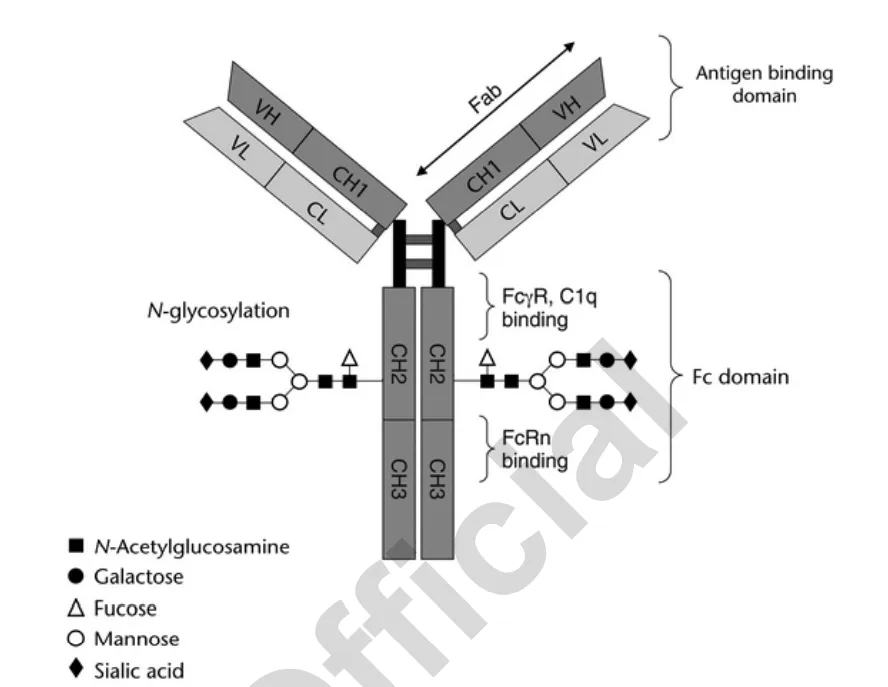
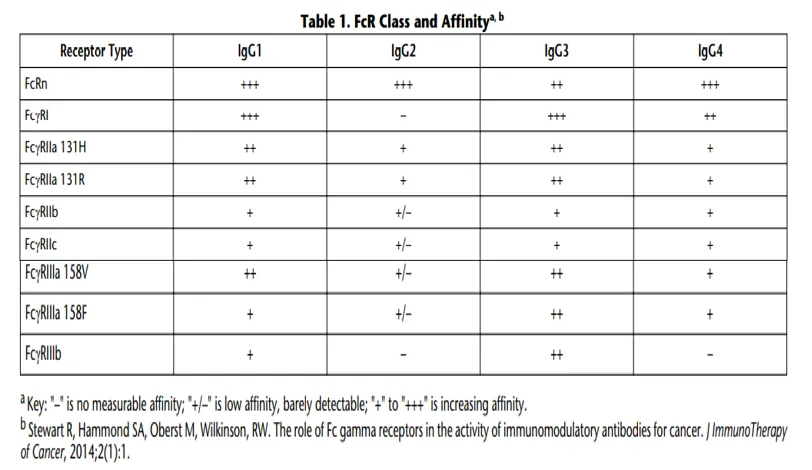
特别注意的是,亲和力测定高度依赖于检测试剂质量、检测方法与实验设计、分析方法等条件。以最新版美国药典为例,在USP1108章节里,详细论述了针对FcRs相关结合分析方法及其注意事项。简单归纳一下,检测数据的质量取决于三大因素:1. FcRs及相应试剂质量 2. 检测方法及实验设计 3.数据分析方法。
FcRs及相应试剂质量
高质量的FcRs及相应试剂是获得高质量检测数据的前提,例如FcRn,为了获得与IgG高效且PH依赖的结合能力,FcRn蛋白应包含FcRn α链的胞外结构域和β-2微球蛋白(β2M);哺乳动物细胞表达的产品优先推荐,因为其正确的蛋白折叠与翻译后修饰能够最大程度地保证。
检测方法及实验设计
不同的检测方法具有不同的优劣势,但是关键性的检测注意事项包含以下几点:检测方法的灵敏度与检测范围(高灵敏、宽范围优先);偶联方式、配体选取、偶联密度(低偶联密度是检测的关键,因此检测方法必须具有高灵敏度);分子间距,空间位阻,亲合力,物质迁移效应和非特异性结合(高偶联是常见诱因之一);保持分析物浓度稳定(蒸发等效应造成检测浓度不准;大部分Fc–FcγR的亲和力在uM级,这就需要某些检测需要高浓度分析物);实验条件的设定(Buffer条件的调整,例如PH的调整,Buffer对非特异结合的影响等)。
数据分析方法
对于不能在合理时间内达到结合和解离的稳态平衡,但存在动力学信息的相互作用,通过动力学分析获得ka和kd,进而确定亲和常数KD。当结合和解离的动力学非常快,并且在合理的时间内可以达到稳定状态时,可以使用稳态平衡分析来确定KD,不同拟合模型用于确定相互作用的进一步信息(例如,对1:1结合模型较为常见)。
正如USP1108章节及中国药典所描述:SPR的方法在Fc相关检测中具有以下优势:非标记技术;检测灵敏度高;更精确的动力学数据;亲和力检测范围更宽;能够自动化制样;数据分析简单明了;可与参考品一起用于表示相对KD数值。正是具有以上检测优势,目前全球已上市抗体药物与FcRs的检测,超过80%都是使用Biacore来进行检测。
USP 2021 https://online.uspnf.com/uspnf/document/1_GUID-8E3807DF-91F5-49DC-B502-18B495CA9B61_2_en-US

 收藏
收藏 询价
询价