医药创新星河璀璨:2024年Biacore助力FDA获批药物盘点
医药创新星河璀璨:2024年Biacore助力FDA获批药物盘点
抗癌战场:中国创新闪耀国际舞台
Tislelizumab是一种针对PD-1的人源化免疫球蛋白G4(IgG4)变体单克隆抗体,可与人类PD-1的细胞外结构域结合。它竞争性地阻断PD-L1和PD-L2的结合,抑制PD-1介导的负信号传导,并在体外细胞试验中增强T细胞的功能活性。
2024年3月被FDA批准用于治疗既往接受过化疗的不可切除、复发、局部晚期或转移性食管鳞状细胞癌的成年患者。
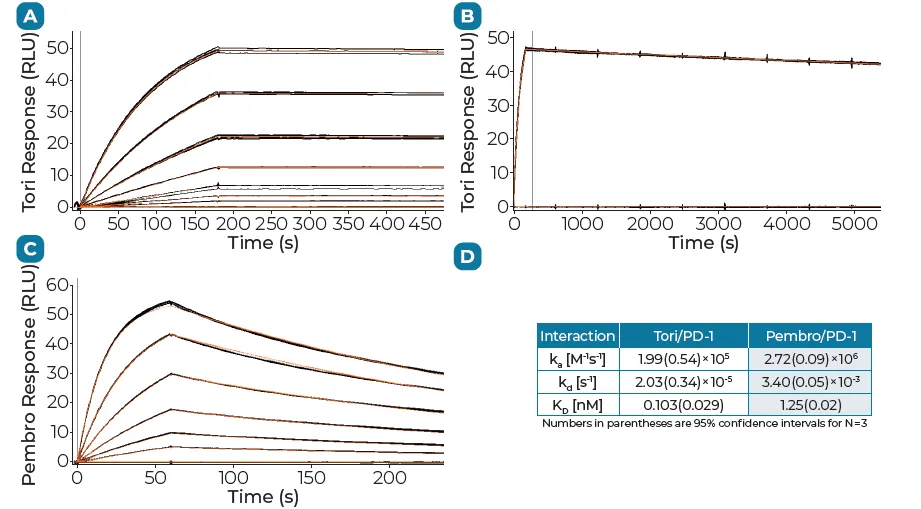
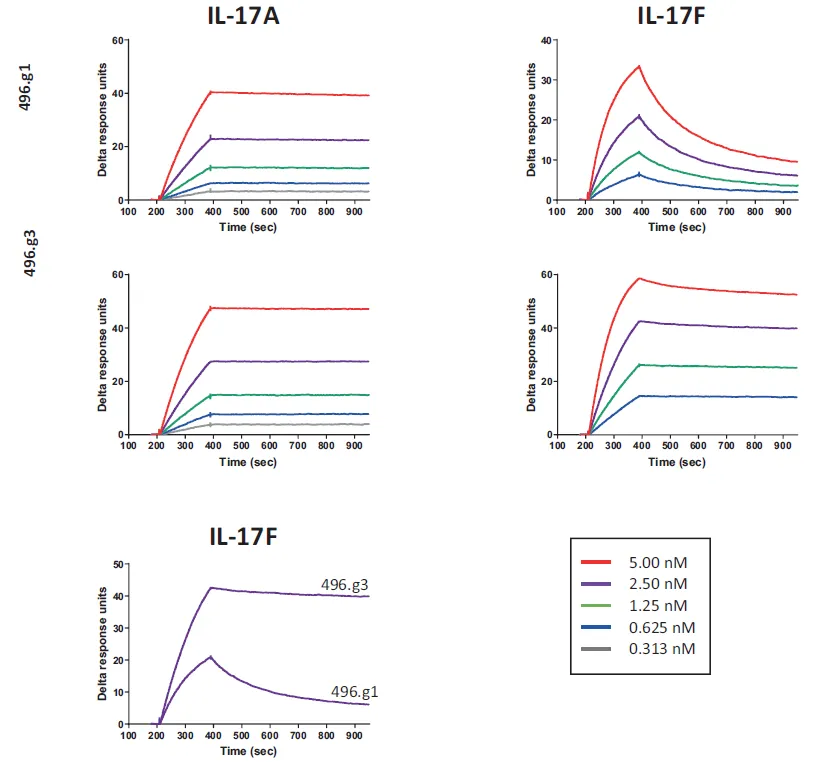
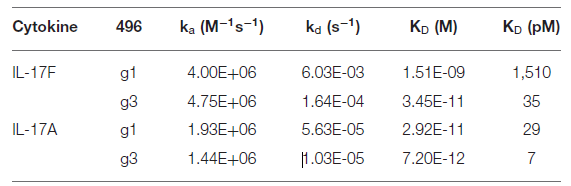
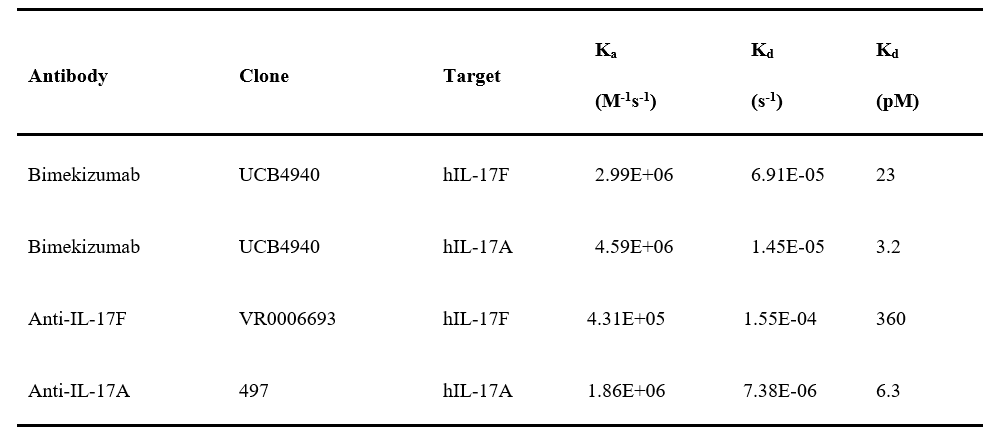
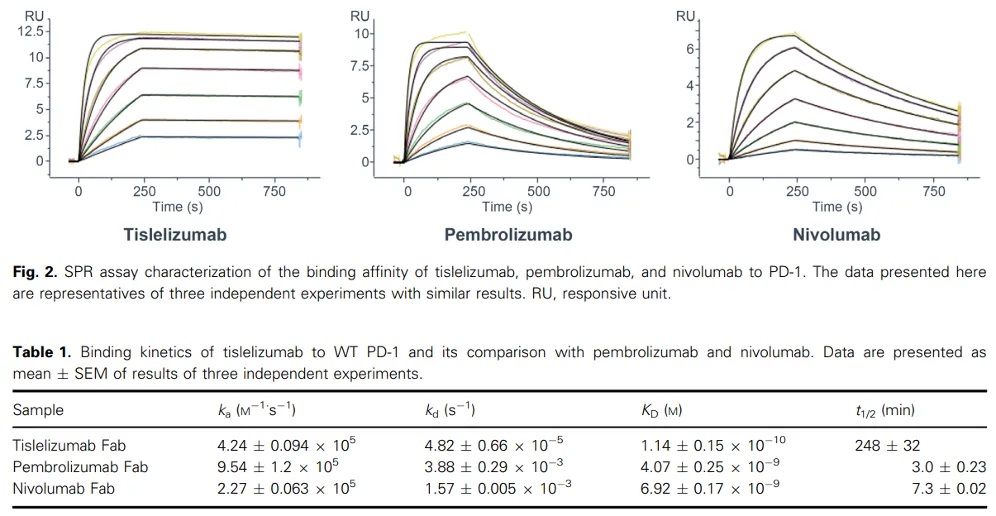
其在整个研发过程中大量使用到了Biacore的检测数据。通过Biacore 8K系统(CM5芯片固定PD-1 Fc融合蛋白),研究团队对比了替雷利珠单抗与已上市抗体Pembrolizumab、Nivolumab的结合参数(图1)。
实验显示,替雷利珠单抗的KD较Pembrolizumab和Nivolumab低1-2个数量级。
其核心机制在于极低的解离速率,较Pembrolizumab减缓80倍,结合半衰期延长30倍以上。这一特性预示了其在体内更持久的靶点占据能力。
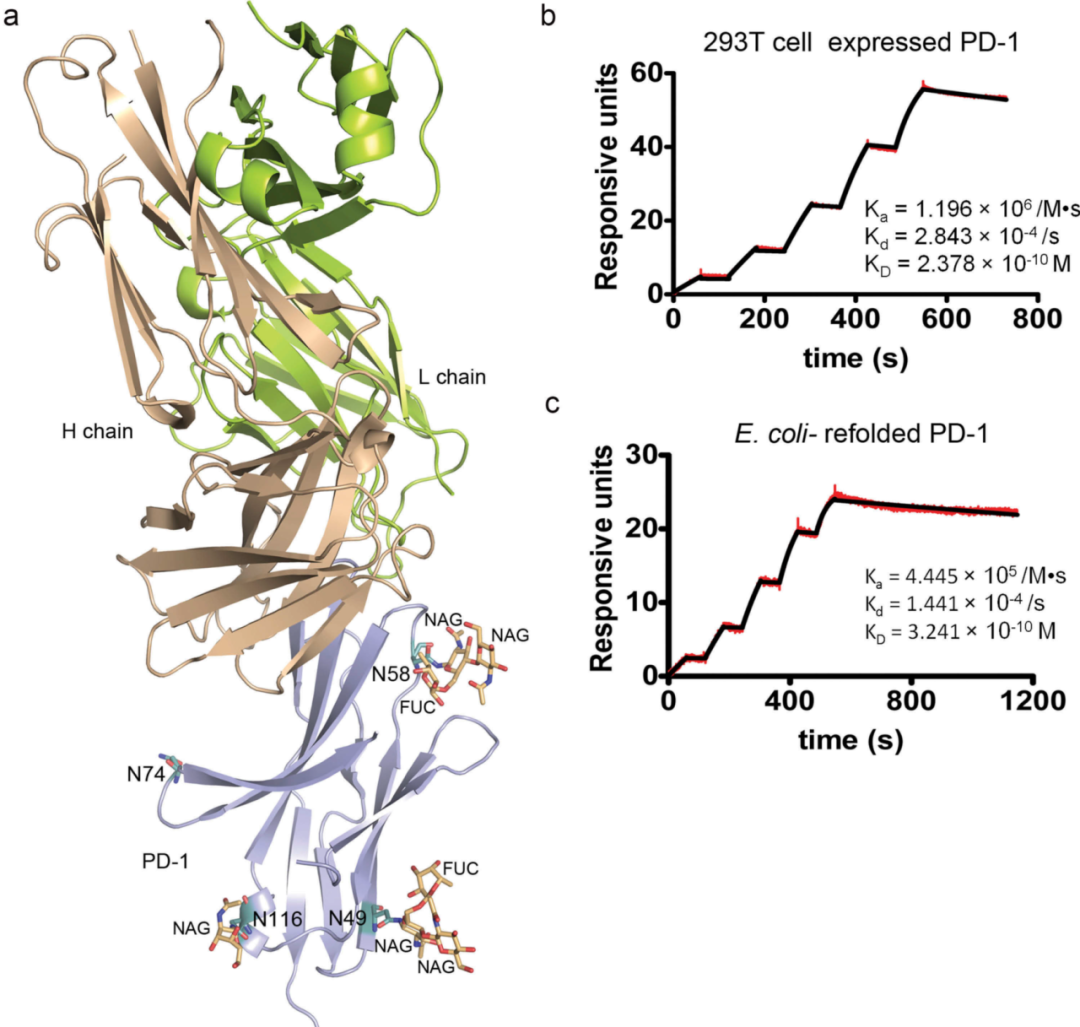
通过PD-1/替雷利珠单抗Fab复合物的晶体结构解析,研究团队发现抗体通过重链CDR3(HCDR3)与轻链CDR1/2(LCDR1/2)形成广泛的结合界面,其中PD-1的CC’环成为关键结合区域。
为验证这一发现,团队利用丙氨酸扫描突变结合Biacore分析,发现CC’环突变体(如Q75A、T76A、D77A)导致替雷利珠单抗的KD值显著上升(图2)。
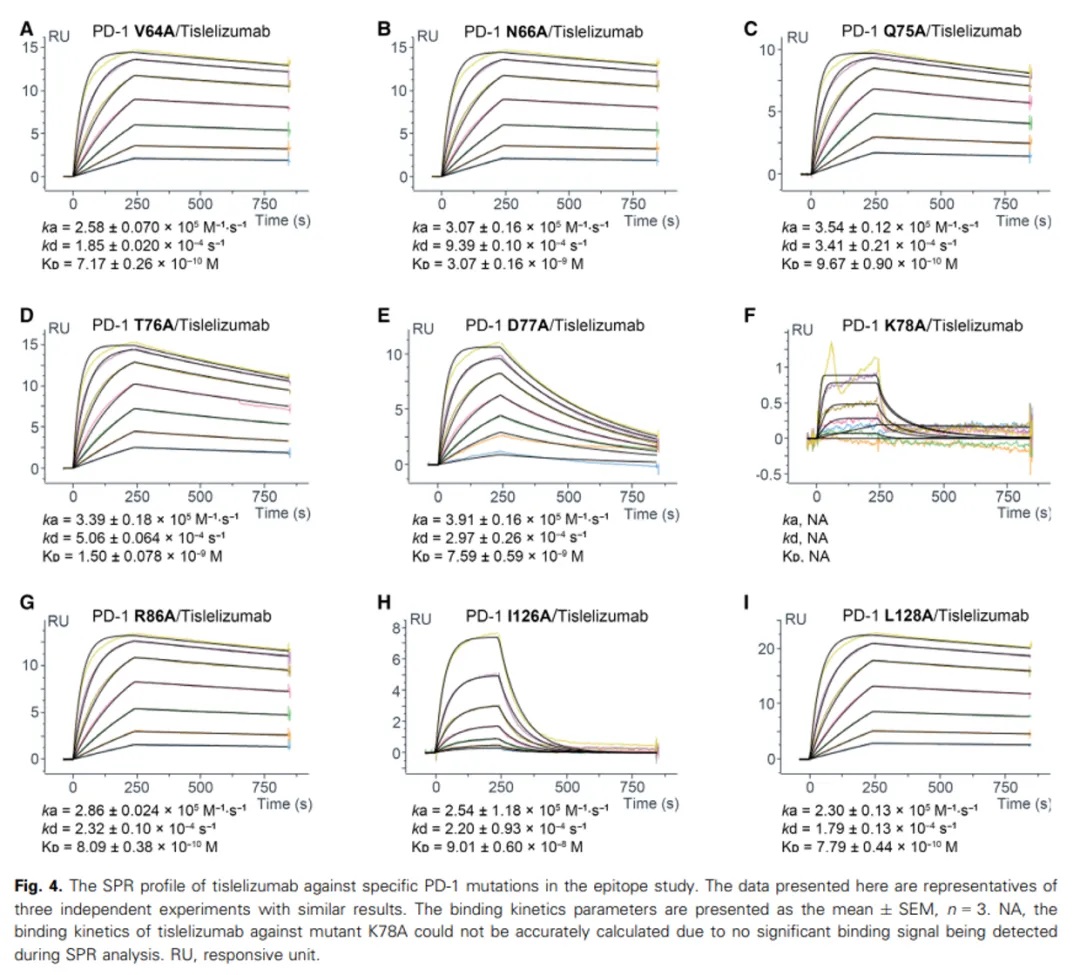
图2:CC’环突变体亲和力数据
Biacore数据与结构分析的整合表明,替雷利珠单抗的结合表位与PD-L1的重叠面积达80%,而Pembrolizumab和Nivolumab的重叠面积仅为66%和44%。
这一差异在细胞水平的P3Z实验中得到验证:替雷利珠单抗在3 μg/mL浓度下可完全阻断PD-L1信号(IL-2分泌抑制>99%),而Pembrolizumab和Nivolumab仅能达到80%和81%的阻断率。
其机制源于替雷利珠单抗的轻链(VL)直接占据PD-L1的结合位点,形成空间位阻效应。结合结构生物学与功能实验,该研究为抗体药物的理性设计提供了范本。
辉瑞新型血友病疗法:TFPI抑制HYMPAVZI

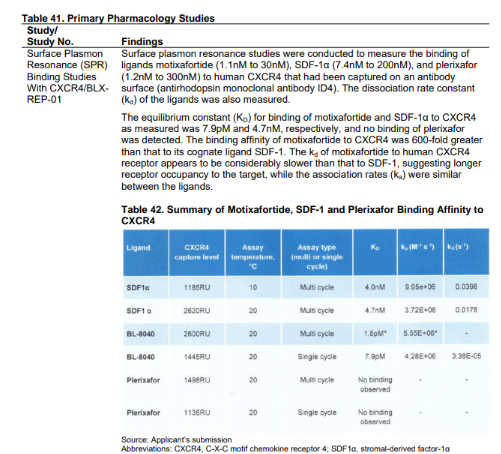
在该药的研发与申报中,SPR实验显示,Marstacimab对人类TFPI K2结构域的解离常数(Kd)为2.63 ± 0.08 nM,对K1K2复合结构域的Kd为7.9 ± 0.33 nM,但不与TFPI的K1域结合。
此外,Marstacimab对不同物种的TFPI K1K2域均表现出相似的抑制作用,具体数值如下:

图3:Marstacimab对不同物种的TFPI K1K2域的亲和力数据
此外,辉瑞研发人员还进行了Marstacimab与Concizumab(另一种抗TFPI单克隆抗体 )的对比研究,见下表。
基于结合亲和力,研发人员预测Marstacimab的临床有效剂量在100至300毫克之间。Marstacimab虽亲和力略低,但其平缓的药效动力学特性可能降低剂量依赖性毒性风险。

图4:Marstacimab与Concizumab对人K1K2及小鼠K1K2的亲和力
其每周一次的皮下注射方案、明确的疗效数据(III期研究ABR降低>65%)及Fc沉默化设计,标志着血友病治疗从“替代缺陷”到“调控内源”的范式转变。
2019年FDA授予的快速通道资格(FTD)进一步凸显其临床价值,未来有望成为全球血友病标准治疗的重要组成。
礼来新型特应性皮炎疗法:IL-13抑制剂Ebglyss
传统治疗方法主要依赖于糖皮质激素和免疫抑制剂,但长期使用这些药物可能引发皮肤萎缩及全身性副作用。尽管新型生物制剂(如IL-4/IL-13抑制剂Dupixent)在治疗中表现出一定疗效,但仍有部分患者对其应答不足。
礼来公司开发的Ebglyss(Lebrikizumab)作为一种高选择性的IL-13单克隆抗体,为患者提供了更为精准的靶向治疗选择。
Lebrikizumab是一种人源化IgG4单克隆抗体,通过特异性结合游离的IL-13蛋白,阻断其与IL-13受体(IL-13Rα1/IL-4Rα复合物)的相互作用,从而抑制下游JAK-STAT信号通路的激活,减少炎症细胞的浸润和瘙痒信号的传递,同时部分恢复皮肤屏障功能。
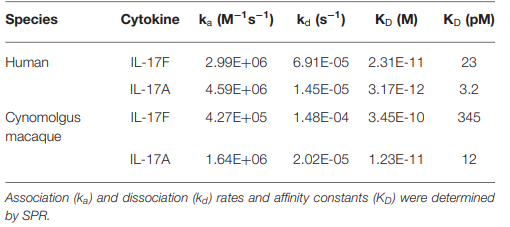
2023年,礼来公司的研究人员发表了一项研究,该研究利用Biacore T200技术对Lebrikizumab、Cendakimab和Tralokinumab三种单克隆抗体与糖基化及非糖基化IL-13的结合能力进行了测试。
研究结果显示,这三种单克隆抗体均能够与糖基化和非糖基化的IL-13结合。尽管它们的结合速率相近,但Lebrikizumab对糖基化和非糖基化人IL-13的解离速率最慢,因此其整体亲和力显著高于Cendakimab和Tralokinumab。
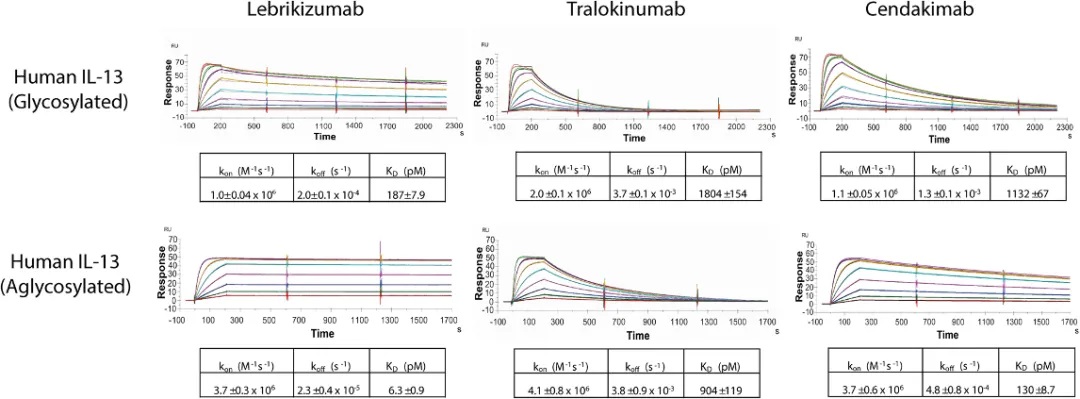
图5:Lebrikizumab、Cendakimab和Tralokinumab对糖基化和非糖基化IL-13的结合能力
此外,研究人员又进一步利用Biacore来评估抗体是否结合在IL-13的相同表位。当IL-13预先结合Cendakimab或Tralokinumab时,Lebrikizumab仍能结合IL-13;而Cendakimab和Tralokinumab无法结合已与自身或其他抗体结合的IL-13。
这一结果表明:Tralokinumab与Cendakimab结合IL-13的重叠表位;Lebrikizumab结合IL-13的不同表位,且其表位空间不与其他两种抗体冲突。
综上所述,Lebrikizumab凭借其高亲和力和独特的表位结合特性,在IL-13抑制剂中展现出核心优势。这些发现对于理解不同IL-13单克隆抗体在AD治疗中的潜在差异具有重要意义,并可能为个体化治疗提供新的见解。
礼来阿尔茨海默新药Donanemab
Donanemab是一种人源化(IgG1)单克隆抗体,可以减少淀粉样β斑块,用于治疗针对患有轻度认知障碍或轻度痴呆症的患者。
在Kisunla的申报材料中, Biacore被用于药靶的亲和力检测,以及结合表位的鉴定。
首先利用Biacore测定了Donanemab与人源AβN3pE-42肽结合的亲和力(KD)最高达到了0.82±0.05 nM;与非焦谷氨酸人Aβe3-16 (KD = 420 nM)相比,对c端截断形式Aβ N3pE-16的亲和力仍然相对较高(KD = 3±2 nM)。未检测到与人源Aβ1-40或小鼠AβN3pE-16的结合。
同时,结合了Biacore的实验结果鉴定得到Donanemab与人源AβN3pE-16结合的表位定位在n端(AβN3pE-7)的5个氨基酸上。

图6:Donanemab申报材料
全球首款HER2双抗Zanidatamab
回顾点击:新型双特异性抗体Zanidatamab结构设计及活性验证思路
Biacore用于定量分析双特异性抗体zanidatamab及其前体与HER2胞外域(ECD)的结合动力学参数。
通过单循环动力学实验(single-cycle kinetics),作者验证了zanidatamab对HER2的亚纳摩尔级高亲和力,并比较了其与亲本抗体的差异(如抗ECD2 Fab经工程优化后亲和力提升8.8倍)。
作者进一步运用Biacore进行了结合模式验证,通过调节芯片表面抗体捕获密度,Biacore实验揭示了zanidatamab的反式结合特性:
在高密度条件下,抗体通过同时结合两个HER2分子(分别靶向ECD2和ECD4)形成交联复合物,导致kd显著降低(密度依赖性)。
而对照抗体trastuzumab(仅靶向ECD4)的kd无密度依赖性,证实其为顺式结合。这一结果为后续观察的HER2簇状聚集和补体依赖的细胞毒性(CDC)提供了机制基础。
随后在抗体工程过程中,Biacore被用于筛选亲和力优化的抗ECD2 Fab突变体。
通过对比野生型与突变体的结合参数(KD从15 nM提升至1.7 nM),作者确认了结构导向的亲和力提升策略的有效性,确保双特异性抗体能够高效交联HER2受体。
结合分析型超速离心(AUC)和冷冻电镜(cryo-EM)数据,Biacore结果进一步支持了zanidatamab诱导的HER2多聚体形成,为其独特的生物学功能(如CDC)提供了分子层面的解释。
在这些药物成功申报的背后,Biacore始终无声护航。
目前,Biacore基于表面等离子共振技术已经被中国、美国和日本药典收录。2024年也荣幸地被国家药品监督管理局组织制定的《抗体偶联药物药学研究与评价技术指导原则》列为推荐的结合活性检测方法。
Biacore技术符合GxP和21 CFR Part 11法规的要求,其准确稳定的数据质量已经得到了药企和监管机构的广泛应用和认可,能够为企业加快抗体药物上市保驾护航。
据不完全统计,超过80%的抗体药物在其早期研发及申报过程中都会用到Biacore,通过动力学参数为药物优化提供“黄金标尺”。从双抗的精准协同到单抗的靶向锁定,从亲和力微调到脱靶风险预测,Biacore以数据为语言,书写着抗体药物从实验室到病床的“通关密码”。

 收藏
收藏 询价
询价