与电穿孔 (EP) 相比,经工程改造的 T 细胞的比例更高
使用用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒将 mRNA 递送至活化的人原代 T 细胞,从而增加经工程改造的 T 细胞的数量。已证明,与 EP 相比,该方法是一种更有效的基因递送方法。

在处理后 24 至 48 小时通过流式细胞术以蛋白表达测量转染效率。EP 按照生产商的方案进行,而 LNP 处理按照 Spark™ 用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒方案进行。未处理的细胞 (UT) 用作对照。**p<0.01,****p<0.0001(单因素 ANOVA)。
均质化的细胞蛋白表达
用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒可对人原代 T 细胞进行工程改造,在经过处理的细胞群中实现高度均质化的蛋白表达。

在处理后 24 和 48 小时,使用流式细胞术生成细胞表面蛋白表达的代表性平均荧光强度 (MFI) 图。按照生产商的方案进行 EP。未处理的细胞 (UT) 用作对照。
高度活性 T 细胞
使用用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒进行体外 基因递送后,活化的人原代 T 细胞仍保持高度活性。
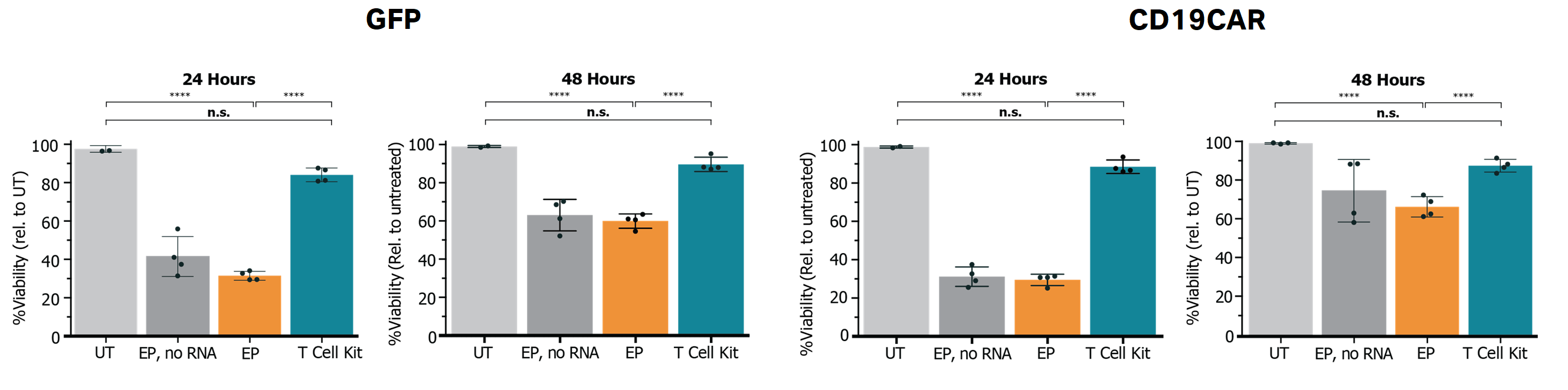
在处理后 24 和 48 小时通过流式细胞术测量细胞活力。EP 按照生产商的方案进行,而 LNP 处理按照 Spark™ 用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒方案进行。未处理的细胞 (UT) 用作对照。****p < 0.0001(单因素 ANOVA)。
用于现成细胞治疗的多步骤 T 细胞工程改造
实现高效基因组编辑敲除与高水平 CD19 CAR 表达。可对正常且有活性的“通用”CAR T 细胞进行工程改造,这些细胞可有效杀伤 CD19+ 肿瘤细胞。
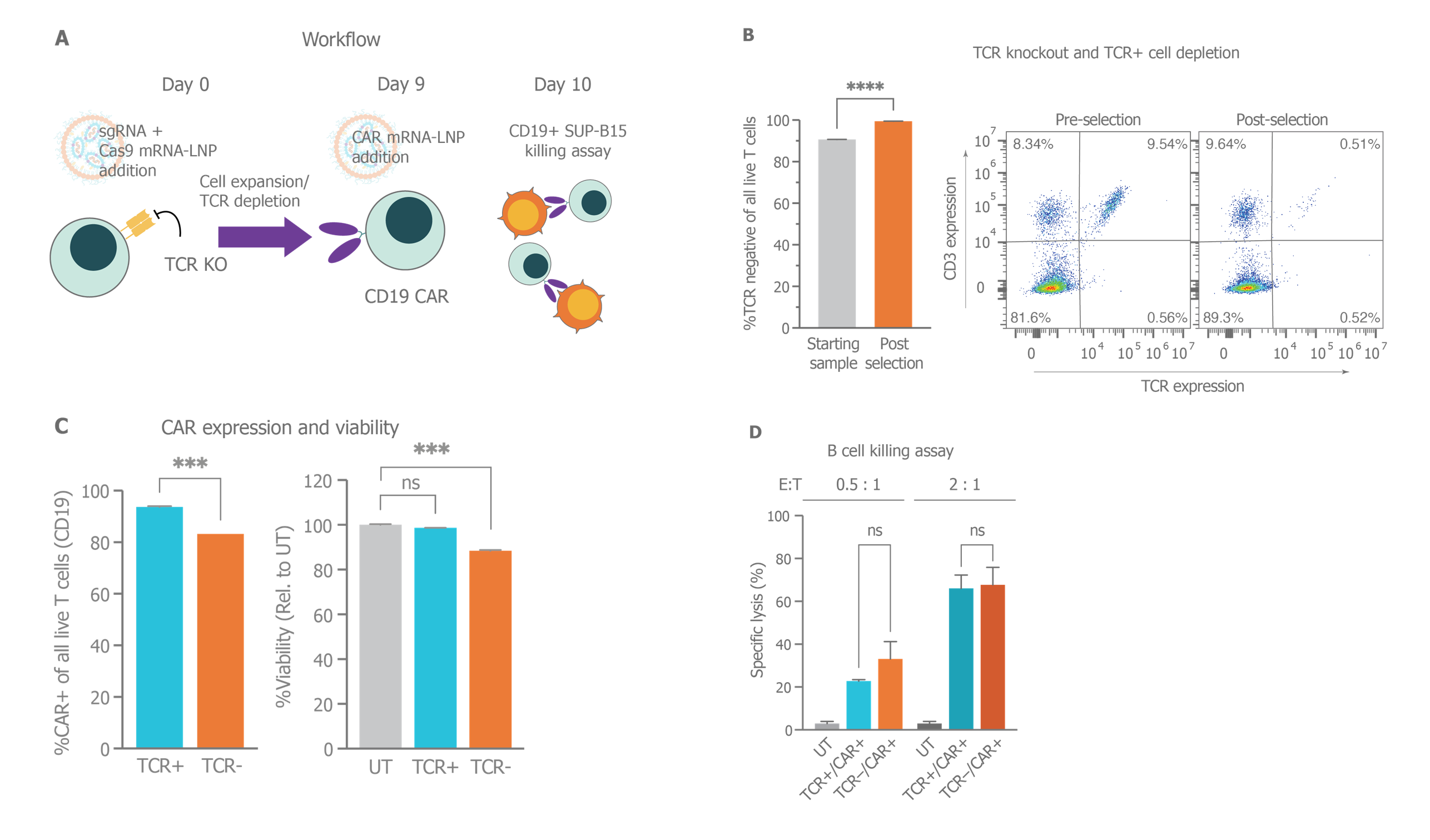
A) 实验示意图,将含有 sgRNA + Cas9 mRNA 的 mRNA-LNP 添加到原代 T 细胞中。在用 CD19 CAR mRNA-LNP 处理之前对细胞进行扩增。在 CAR mRNA-LNP 处理后 24 小时,进行 16 小时的 CD19+ T 细胞杀伤试验。B) 评估了 TCR 敲除效率。对起始样品进行 TCR 阴性选择,以进一步纯化 TCR 细胞群。C) 左侧:当细胞群为 TCR+ 或 TCR− 时,用 3.2 μg RNA/百万细胞的 CAR mRNA-LNP 处理 24 小时后的 CD19 CAR 表达百分比。右侧:标准化至未处理的细胞群后的相应细胞活力。D) 在所示效应细胞与靶细胞比率 (E:T) 下,通过 UT、TCR+/CAR+ 或基因编辑 TCR−/CAR+ T 细胞对 CD19+ B 细胞 (SUP-B15) 进行的功能性杀伤作用。对于所有情况,均应用 3.2 μg RNA/百万细胞的剂量。误差线代表标准差。在所示组中使用 t 检验或单因素 ANOVA 评价统计学意义 (2)。
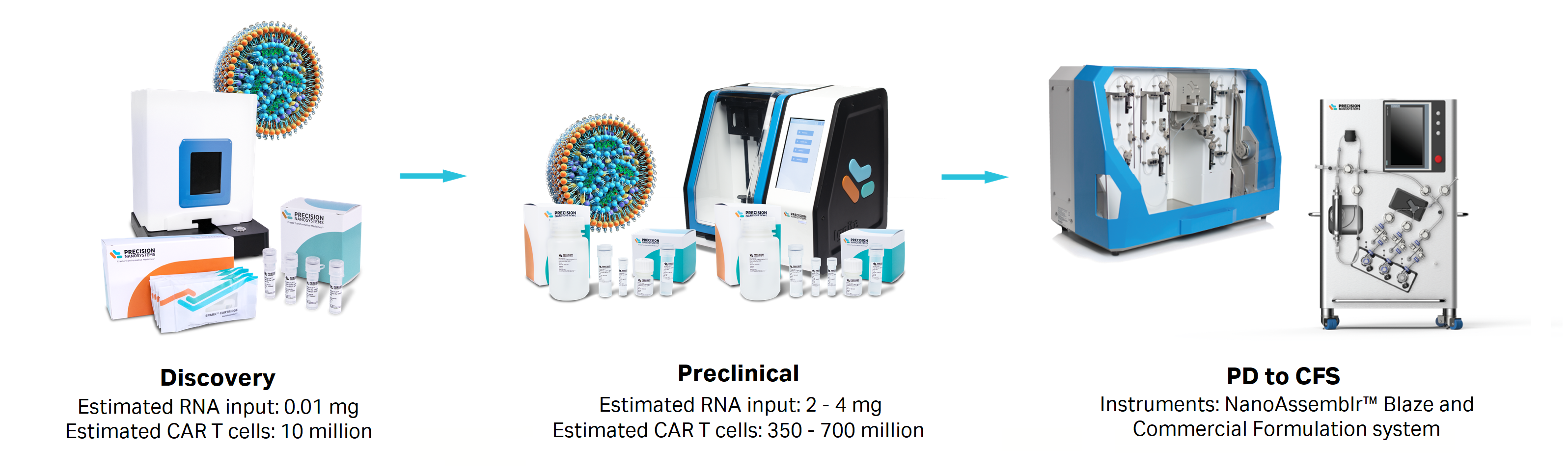
从发现阶段扩大到临床前阶段
数据表明,GenVoy-ILM™ T 细胞试剂盒和可放大 NanoAssemblr™ 平台能够在 Spark™ 和 Ignite™ 仪器上实现可靠和等效的表现,从而从发现阶段扩大到临床前阶段。
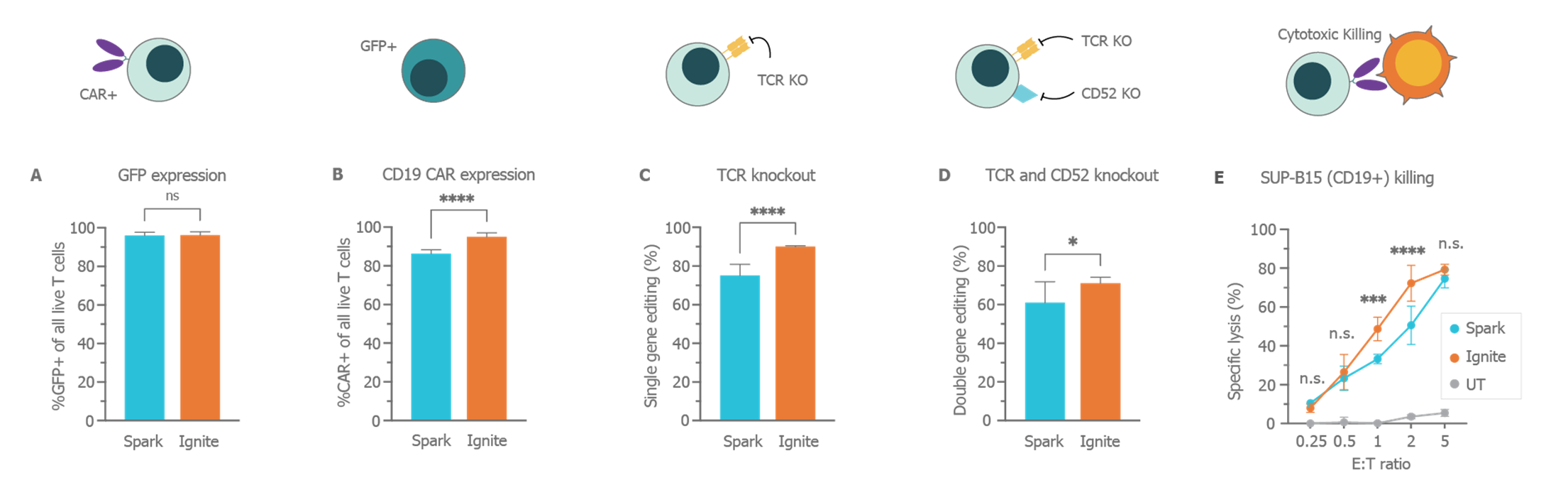
A) GFP 和 B) CD19 CAR 转染效率(添加 mRNA-LNP 后 24 小时)。C) 单靶(T 细胞受体,TCR)敲除的水平和 D) 双靶(TCR 和 CD52)敲除的水平(通过 sgRNA 和 Cas9 mRNA 递送实现)。E) 在 16 小时联合培养实验中对 CD19+ B 细胞 (SUP-B15) 的功能性杀伤作用。对于所有情况:将 3.2 μg RNA/百万细胞的剂量应用于人原代 T 细胞。RNA-LNP 是根据 Spark™ 或 Ignite™ 上用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒用户指南制备的。通过流式细胞术检测平均基因表达和基因敲除,显示最少 n = 8 份独立 RNA-LNP 制剂和 n = 2 个供体。通过流式细胞术检测功能性杀伤表现,显示 n = 2 份独立 RNA-LNP 制剂和 n = 2 个供体。误差线表示标准差,在选定组中使用 t 检验评价统计学意义 (2)。
试剂盒组分
|
用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒,Spark™(产品编号 1000700) |
用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒,带 5 个 Spark™ 芯片(产品编号 1000683) |
用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒,Ignite™,3 mL(产品编号 1001144) |
用于 mRNA 的 GenVoy-ILM™ T 细胞试剂盒,Ignite™,6 mL(产品编号 1001161) |
| 脂质混合物 |
90 µL |
90 µL |
3 mL |
6 mL |
| 制剂缓冲液 (10X) |
30 µL |
30 µL |
2 mL |
4 mL |
| 稀释缓冲液 (10X) |
900 µL |
900 µL |
40 mL |
80 mL |
| 冷冻保存缓冲液 (2X) |
– |
– |
3 mL |
6 mL |
| 载脂蛋白-E (ApoE) |
50 µg |
50 µg |
500 µg |
500 µg x 2 |
| Spark 芯片 |
– |
5 |
– |
– |

 收藏
收藏 询价
询价