流程易于并入标准 CD34+ HSC 细胞培养方案中
CD34+ HSC LNP 试剂盒易于并入 CD34+ HSC 工作流程中,可用于基于 mRNA 的基因表达和 CRISPR/Cas 基因编辑应用。一般工作流程概述如下。
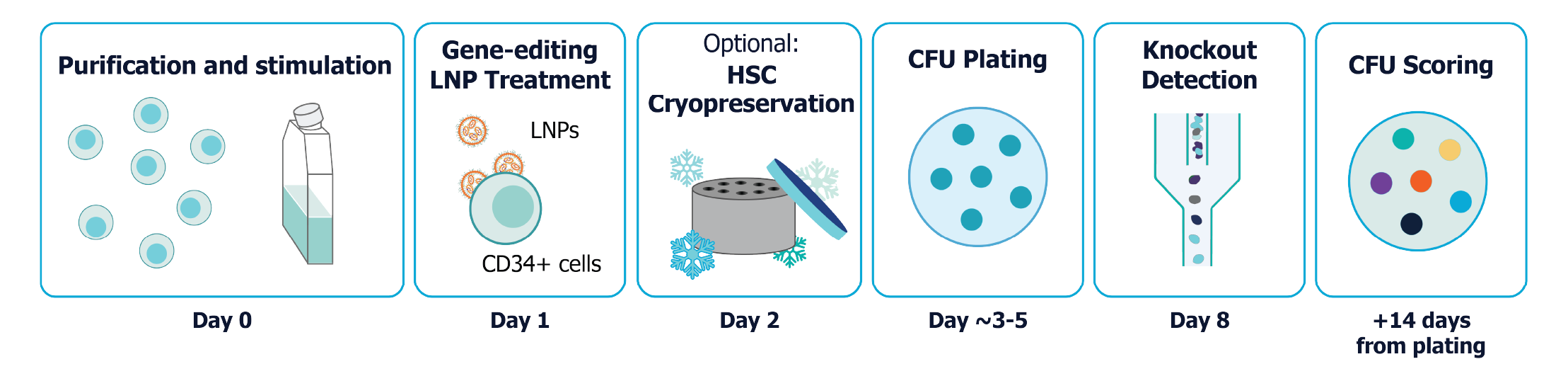
LNP 处理和 HSC 细胞培养工作流程示意图。LNP 生产可与细胞培养工作流程分离,从而增加工作流程的灵活性和简单性。
CD45 的剂量依赖性基因敲除
在 NanoAssemblr™ Spark™ 系统中使用 CD34+ HSC LNP 试剂盒 (100 µL) 和在 NanoAssemblr™ Ignite™ 仪器中使用 CD34+ HSC LNP 试剂盒 (2 mL),对来源于人脐血和人动员外周血的 CD34+ HSC 进行剂量依赖性高效基因组编辑。
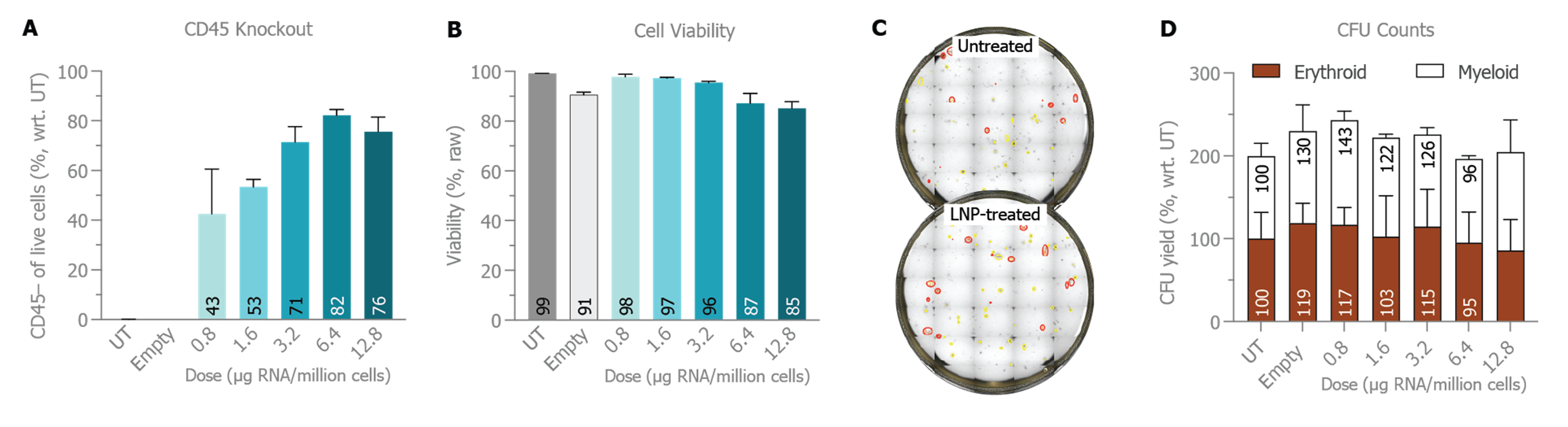
A) NanoAssmblr™ Spark™ 仪器上产生的 CRISPR-Cas9 mRNA 和 sgRNA LNP 的 CD45 剂量反应。B) 相应细胞活力。C) 未经处理和经 CRISPR RNA-LNP 处理的 CFU 平板展示图片。D) 未经处理 (UT) 样品、空白 LNP 处理样品和经 CRISPR RNA-LNP 处理样品的标准化红系和髓系集落的产量。
经 LNP 处理后的细胞增殖和活力
经 LNP 处理的 HSC 显示出较高的细胞增殖和活力水平。
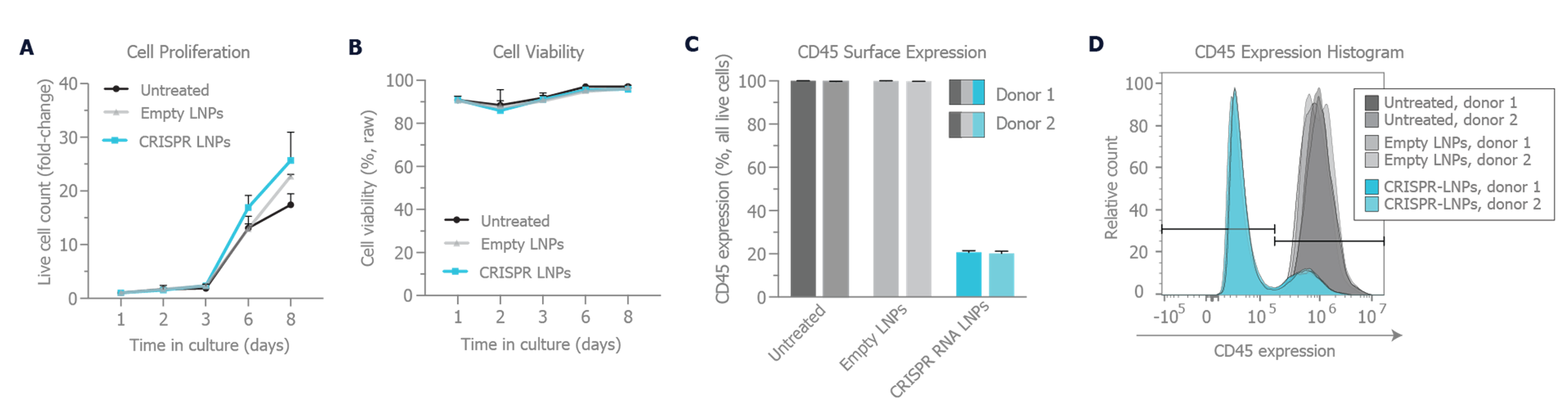
A) 细胞增殖和 B) 在 LNP 介导、靶向 CD45 经 CRISPR RNA-LNP 处理的 HSC 基因编辑后,对细胞存活能力超过 1 周的监测C) 通过流式细胞术分析 CD45 表面表达,对比 n = 2 个供体中 LNP 介导的基因编辑效果 D) 相应的直方图。
经 LNP 处理后 HSC 的冷冻保存与冻融处理
经 LNP 处理的 HSC 在冷冻保存条件下显示出较高细胞活力和产量。此外,细胞在保持 CD45 敲除效率的同时,保留了其可植入的 HSC 表型分布。
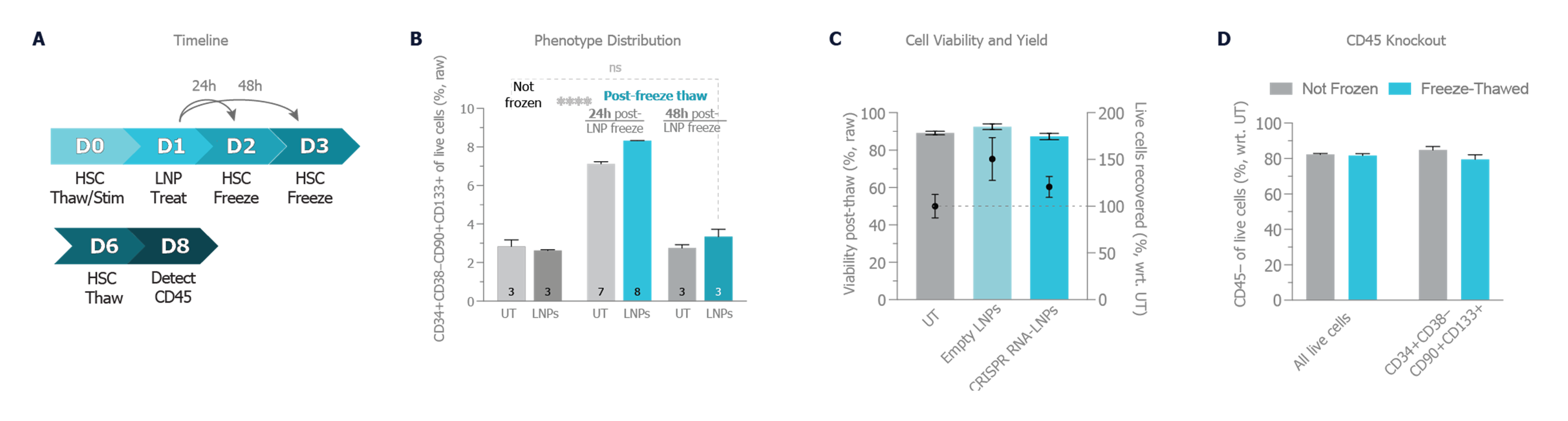
LNP 介导的 CRISPR Cas9 基因编辑后 HSC 的冷冻保存。A) HSC 冻融循环 (F/T) 的示意图。B) 经 LNP 处理后,在冷冻的 24 或 48 小时的时间点,评估解冻后或非冷冻状态下长期再增殖的 HSC 表型水平。C) 经 LNP 处理 24 小时后,在 F/T 循环下的细胞活力和活细胞恢复比率。D) 在总活细胞和可植入的表型 (CD34+ CD38- CD90+ CD133+) 的冻融和新鲜的经 LNP 处理 HSC 中,观察到的 CD45 敲除效率。
细胞培养和 RNA-LNP 生产的规模扩大
CD34+ HSC LNP 试剂盒可用于 NanoAssemblr™ Spark™ 和 NanoAssemblr™ Ignite™ 仪器。还可通过 BioPharma Services 对试剂进行规模扩大工艺开发和 GMP 生产。
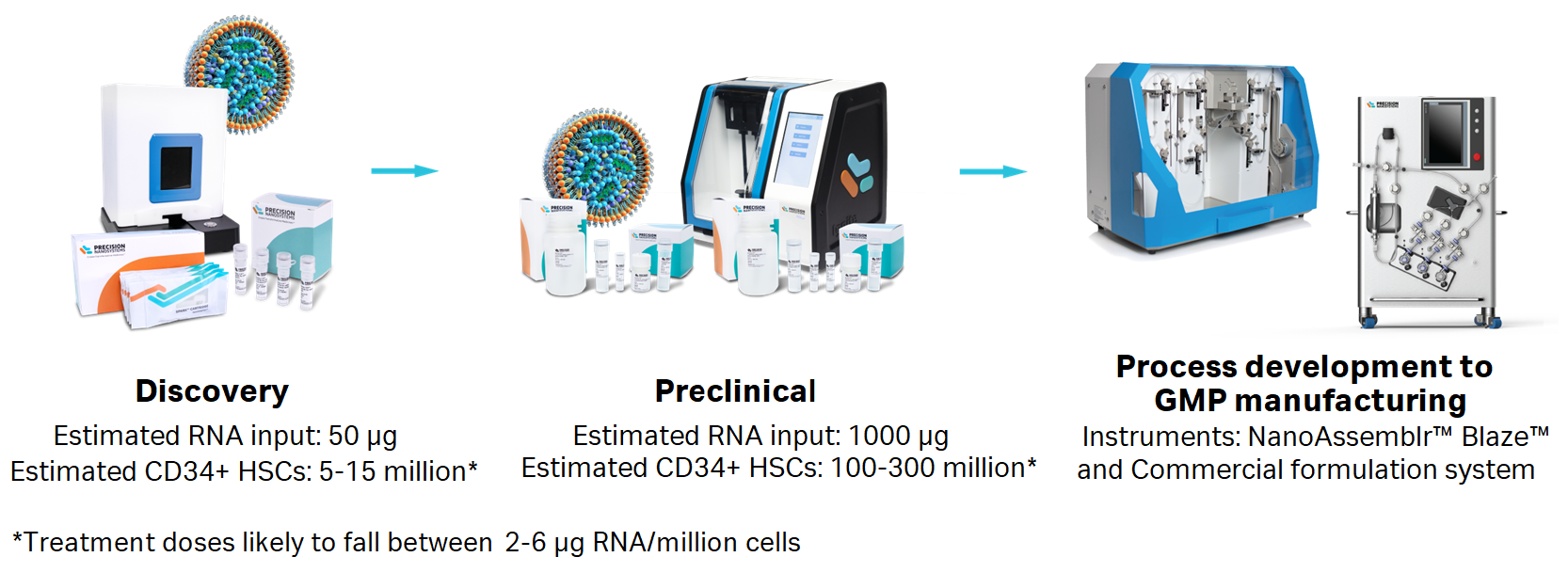
CD34+ HSC LNP 试剂盒可与 NanoAssemblr™ 平台相结合,可在 Spark™ 和 Ignite™ 仪器上实现可靠和等效的表现,并提供从发现到临床前研究的无缝可放大性。
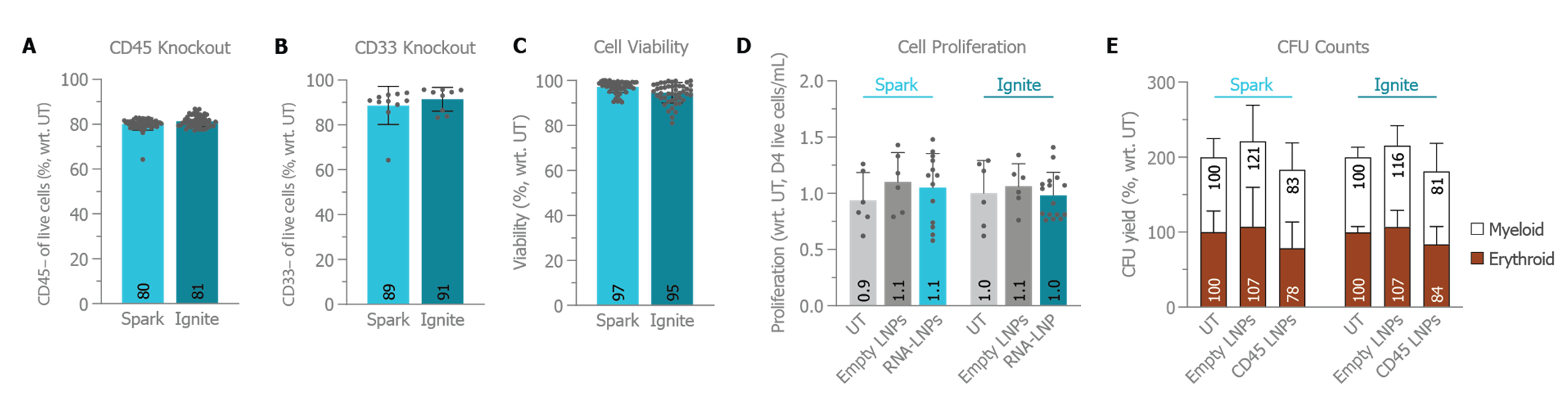
A) CD45 敲除和 B) CD33 敲除(总活细胞群),以及 C) 相应的细胞活力。A-C 包括 >20 项使用 >4 个独特供体的独特实验。D) 对未经处理、空 LNP 和装载 CRISPR-Cas9 RNA 的经 LNP 处理 HSC,使用自动细胞计数器评估了其增殖情况。E) 使用一个自动 CFU 计数器、5 项使用 Spark™ 的独立实验和 2 项使用 Ignite™ 仪器的独立实验评估未处理、空 LNP 和装载 CRISPR-Cas9 RNA 的经 LNP 处理 HSC 的克隆源性。
试剂盒组分
|
CD34+ HSC LNP 试剂盒,100 µL(产品编号 1003000) |
CD34+ HSC LNP 试剂盒,100 µL,带芯片(产品编号 1004000) |
CD34+ HSC LNP 试剂盒,2 mL(产品编号 105000) |
| 脂质混合物 |
100 µL |
100 µL |
2 mL |
| 制剂缓冲液 1 型 |
400 µL |
400 µL |
1.6 mL |
| 稀释缓冲液 1 型 |
1.5 mL |
1.5 mL |
100 mL (10X) |
| 冷冻保存缓冲液 2 型 |
– |
– |
6 mL |
| 载脂蛋白-E3 (ApoE3) |
100 µg |
100 µg |
500 do |
| Spark™ 芯片 |
– |
5 |
– |

 收藏
收藏 询价
询价